
科目: 来源: 题型:
【题目】(1)MgCl2固体中含离子总数为1.806×1024个,将其配成2000mL溶液,求:
①c(MgCl2)=_____。
②c(Cl-)=____。
(2)配制500mL含Fe3+56g的Fe2(SO4)3溶液,需要6.25mol/L的Fe2(SO4)3溶液的体积为___mL。
(3)______mL 2 mol/L的NaOH溶液中所含溶质的质量和200mL 1 mol/L的Na2SO4溶液所含溶质的质量相等。
(4)11.7克NaCl配制成100mL溶液,此溶液中c(Cl-)与标准状况下44.8升HCl配成V L溶液中的c(Cl-)相等,求V=______。
(5)含34.2g Al2(SO4)3的溶液,其体积与0.5mol/L含Na2SO4质量为142g的溶液体积相同。求该Al2(SO4)3溶液中c(SO42-)=__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】掌握仪器的名称、组装及使用方法是中学化学实验的基础,根据如下图所示实验装置,回答下列问题。

(1)写出下列仪器的名称:
①_____________, ②_____________。
(2)若利用装置Ⅰ分离酒精和水的混合物,还缺少 的仪器是_____________,将仪器补充完整后进行的实验操作的名称为________;②的进水口是______(填“f”或“g”)。实验中,仪器①中需加入沸石,其作用为________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在100℃时,将0.100mol N2O4气体充入1L恒容抽空的密闭容器中,发生反应:N2O4(g)![]() 2NO2(g)。隔一定时间对该容器内物质的浓度进行分析得到如表数据。回答有关问题;
2NO2(g)。隔一定时间对该容器内物质的浓度进行分析得到如表数据。回答有关问题;
时间(s) | 0 | 20 | 40 | 60 | 80 |
c(N2O4)/mol·L-1 | 0.100 | c1 | 0.050 | c3 | c4 |
c(NO2)/mol·L-1 | 0.000 | 0.060 | c2 | 0.120 | 0.120 |
①c3________c4(填“>”、“<”或“=”)。
②在上述条件下,从反应开始直至达到化学平衡时,N2O4的平均反应速率为_________mol·L-1·s-1。
③达平衡后下列条件的改变可使NO2气体浓度增大的是_______(填序号)。
A.扩大容器的容积 B.再充入一定量的N2O4
C.分离出一定量的NO2 D.再充入一定量的He
④若在相同条件下,起始时只充入0.200 mol NO2气体,则达到平衡时NO2气体的转化率为_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】对利用甲烷消除NO2污染进行研究,CH4+2NO2 ![]() N2+CO2+2H2O。在1L密闭容器中,控制不同温度,分别加入0.50molCH4和1.2molNO2,测得n(CH4)随时间变化的有关实验数据见下表。有关说法正确的是( )
N2+CO2+2H2O。在1L密闭容器中,控制不同温度,分别加入0.50molCH4和1.2molNO2,测得n(CH4)随时间变化的有关实验数据见下表。有关说法正确的是( )
组别 | 温度 | 时间/min n/mol | 0 | 10 | 20[] | 40 | 50 |
① | T1 | n(CH4) | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
② | T2 | n(CH4) | 0.50 | 0.30 | 0.18 | … | 0.15[] |
A. 组别①中,0~20min内,NO2的降解速率为0.0125 mol·L-1·min-1
B. 由实验数据可知实验控制的温度T1<T2
C. 40min时,表格中T2应填的数据为0.18
D. 0~10min内,CH4的降解速率①>②
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定的温度和压强下,水成为“超临界状态”,此时水可将CO2等含碳化合物转化为有机物,这就是“水热反应”。生物质在地下高温高压条件下通过水热反应可生成石油、煤等矿物能源。下列说法错误的是
A. 二氧化碳与超临界水作用生成汽油的反应,属于放热反应
B. “水热反应”是一种复杂的化学变化
C. 火力发电厂可望利用废热,将二氧化碳转变为能源物质
D. 随着科技的进步,“水热反应”制取能源有望实现地球上碳资源的和谐循环
查看答案和解析>>
科目: 来源: 题型:
【题目】在体积均为1.0 L的两恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1 mol CO2和0.2 mol CO2,在不同温度下反应 CO2(g)+C(s)![]() 2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是
2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是

A. 反应 CO2(g)+C(s)![]() 2CO(g)的 ΔS>0、ΔH<0
2CO(g)的 ΔS>0、ΔH<0
B. 体系的总压强p总:p总(状态Ⅱ)<2p总(状态Ⅰ)
C. 体系中c(CO):c(CO,状态Ⅱ)<2c(CO,状态Ⅲ)
D. 逆反应速率v逆::v逆(状态Ⅰ)>v逆(状态Ⅲ)
查看答案和解析>>
科目: 来源: 题型:
【题目】计算下列各数值。
(1)3.1g Na2X含有Na+ 为0.1mol,则Na2X的摩尔质量为__,X的相对原子质量为__。
(2)8.5g氢氧根离子含有的电子数目为_______。
(3)14g C2H4与C4H8的混合物所含质子的物质的量为__。
(4)1.43g Na2CO3·10H2O溶于水配成100mL溶液,则c(Na2CO3)为__mol/L;取20mL该溶液,加入__mL水得到0.004mol/L的Na2CO3溶液(设稀释时对溶液体积的影响忽略不计)。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,向20 mL 0.1 molL-1氨水溶液中滴加一定浓度的稀盐酸,溶液中由水电离的氢离子浓度随加入盐酸体积的变化如图所示。
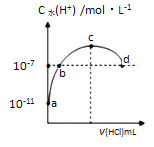
则下列说法正确的是
A. 常温下,0.1molL-1氨水的电离常数K约为1×10-5molL-1
B. a、b之间的点一定满足:c(NH4+)>c(Cl-)>c(OH-)>c(H+)
C. c点溶液中c(NH4+)=c(Cl-)
D. d点代表两溶液恰好完全反应
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH=-41 kJ·mol-1。相同温度下,在容积相同的两个恒温密闭容器中,加入一定量的反应物发生反应。相关数据如下:
CO2(g)+H2(g) ΔH=-41 kJ·mol-1。相同温度下,在容积相同的两个恒温密闭容器中,加入一定量的反应物发生反应。相关数据如下:
容器编号 | 起始时各物质物质的量/mol | 达平衡过程体系能量的变化 | |||
CO | H2O | CO2 | H2 | ||
① | 1 | 4 | 0 | 0 | 放出热量:32.8 kJ |
② | 0 | 0 | 1 | 4 | 热量变化:Q kJ |
下列说法中,不正确的是( )
A. 容器①中反应达平衡时,CO的转化率为80%
B. 容器①中CO的转化率等于容器②中CO2的转化率
C. 平衡时,两容器中CO2的浓度相等
D. 容器①时CO的反应速率等于H2O的反应速率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com