
科目: 来源: 题型:
【题目】利用氯碱工业的盐泥[含Mg(OH)2及少量的CaCO3、MnCO3、FeCO3、Al(OH)3、SiO2等]生产MgSO4·7H2O的工艺流程如下:
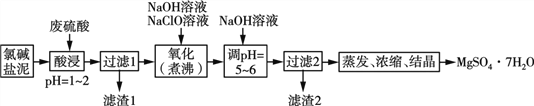
(1)酸浸时,FeCO3与硫酸反应的离子反应方程式为___________________;滤渣1的主要成分为CaSO4和____(填化学式);为了提高浸取率可采取的措施有____(填字母)。
a. 多次用废硫酸浸取 b. 减小盐泥粒度并充分搅拌
c. 延长浸取时间 d.适当的提高酸浸的温度
(2)氧化时,次氯酸钠溶液将MnSO4氧化为MnO2的离子方程式为__________________;滤渣2为MnO2和____、____(填化学式)。
(3) 镁的碳化物常见的有MgC2和Mg2C3两种,分别可发生水解反应生成乙炔和丙二烯,MgC2的电子式为________ 。
(4)一种碱式碳酸镁[4MgCO3·Mg(OH)2·5H2O]可用作防火保温材料,用化学方程式说明可作防火材料的原理:____________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】雾霾天气严重影响人们的生活和健康。其中首要污染物为可吸入颗粒物PM2.5,其主要来源为燃煤、机动车尾气等。因此改善能源结构、机动车限号等措施能有效减少PM2.5、SO2、NOx等污染。
请回答下列问题:
(1)将一定量的某利M2.5样品用蒸馏水溶解制成待测试样(忽略OH-)。常温下测得该训试样的组成及其浓度如下表:根据表中数据判断该试样的pH=___________。

(2)汽车尾气中NOx和CO的生成:①已知汽缸中生成NO的反应为:N2(g)+O2(g) ![]() 2NO(g)△H>0恒温,恒容密闭容器中,下列说法中,能说明该反应达到化学平衡状态的是____。
2NO(g)△H>0恒温,恒容密闭容器中,下列说法中,能说明该反应达到化学平衡状态的是____。
A.混合气体的密度不再变化
B.混合气体的压强不再变化
C.N2、O2、NO的物质的量之比为1∶1∶2
D.氧气的转化率不再变化
(3)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。
已知:H2(g)+1/2O2(g)=H2O(g)△H=-241.8kJ·mol-1
C(s)+1/2O2(g)=CO(g)△H=-110.5kJ·mol-1
写出焦炭与水蒸气反应的热化学方程式:_____________。
②洗涤含SO2的烟气。下列可作为洗涤含SO2的烟气的洗涤剂的是___________。
A.浓氨水 B.碳酸氢钠饱和溶液 C.FeCl2饱和溶液 D.酸性CaCl2饱和溶液
(4)汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领域的重要课题。某研究性小组在实验室以Ag-ZSM-5为催化剂,测得NO转化为N2的转化率随温度变化情况如图所示。若不使用CO,温度超过775K,发现NO的分解率降低,其可能的原因为______,在n(NO)/n(CO)=1的条件下,为更好的除去NOx物质,应控制的最佳温度在_____K左右。

(5)车辆排放的氮氧化物、煤燃烧产生的二氧化硫是导致雾霾天气的“罪魁祸首”。活性炭可处理大气污染物NO。在5L密闭容器中加入NO和活性炭(假设无杂质),一定条件下生成气体E和F。当温度分别在T1℃ 和T2℃时,测得各物质平衡时物质的量(n/mol)如下表:

①写出NO与活性炭反应的化学方程式_____,②若T1<T2,则该反应的△H______O (填”>”、“<”或“=”)。
③上述反应T1℃时达到化学平衡后再通入0.1molNO气体,则达到新化学平衡时NO的转化率为__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列过程不属于水解反应的是( )
A. 吃馒头时,经咀嚼后有甜味
B. 淀粉溶液与稀硫酸共热一段时间后,滴加碘水不显蓝色
C. 不慎将浓硝酸沾到皮肤上会出现黄色斑痕
D. 油脂与氢氧化钠溶液共热可以制得肥皂
查看答案和解析>>
科目: 来源: 题型:
【题目】下列属于物理变化的是
A. 麦芽糖和稀硫酸共热
B. 蛋白质溶液中加入饱和NaCl溶液,有沉淀析出
C. 蛋白质溶液中加入浓NaOH溶液
D. 氨基酸中加入盐酸
查看答案和解析>>
科目: 来源: 题型:
【题目】书法离不开文房四宝(笔、墨、纸、砚),做笔用的狼毫,研墨用的墨条以及宣纸(即白纸)和做砚台用的砚石的主要成分依次是
A. 多糖、炭黑、蛋白质、无机盐
B. 塑料、煤炭、多糖、无机盐
C. 蛋白质、炭黑、多糖、无机盐
D. 蛋白质、煤炭、多糖、有机玻璃
查看答案和解析>>
科目: 来源: 题型:
【题目】化工生产中常用MnS作沉淀剂除去工业废水中的Cu2+:Cu2+(aq)+MnS(s)![]() CuS(s)+Mn2+(aq)下列有关叙述中正确的是( )
CuS(s)+Mn2+(aq)下列有关叙述中正确的是( )
①MnS的Ksp大于CuS的Ksp ②达到平衡时c(Mn2+)=c(Cu2+) ③溶液中加入少量Na2S固体后,溶液中c(Cu2+)、c(Mn2+)保持不变 ④该反应平衡常数K=
A. ①④ B. ②③
C. ①②③ D. ②③④
查看答案和解析>>
科目: 来源: 题型:
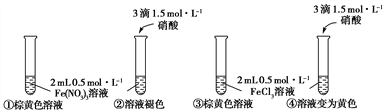
【题目】某实验小组同学依据资料深入探究Fe3+在水溶液中的行为。
资料:
ⅰ.Fe3+在水溶液中以水合铁离子的形式存在,如[Fe(H2O)6]3+;[Fe(H2O)6]3+发生如下水解反应:
[Fe(H2O)6]3+(几乎无色)+nH2O![]() [Fe(H2O)6-n(OH)n]3-n(黄色)+nH3O+(n=0~6);
[Fe(H2O)6-n(OH)n]3-n(黄色)+nH3O+(n=0~6);
ⅱ.[FeCl4(H2O)2]-为黄色。
进行实验:
【实验Ⅰ】
【实验Ⅱ】
分别用试管①、③中的试剂作为待测液,用色度计测定其透光率。透光率越小,溶液颜色越深;透光率越大,溶液颜色越浅。
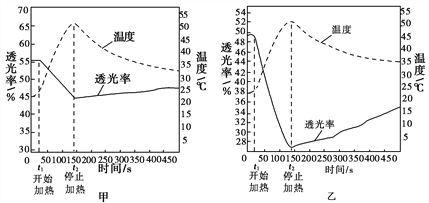
Fe(NO3)3溶液透光率随温度变化曲线 FeCl3溶液透光率随温度变化曲线
(1)实验Ⅰ中,试管②溶液褪色的原因是_________________________________________。
(2)实验Ⅰ中,试管③溶液呈棕黄色与[FeCl4(H2O)2]-有关,支持此结论的实验现象是_____________________________________________________________________________。
(3)由实验Ⅱ图甲、乙可知:加热时,溶液颜色________(填“变浅”“变深”或“不变”)。
(4)由实验Ⅱ,可以得出如下结论:
【结论一】FeCl3溶液中存在可逆反应:[FeCl4(H2O)2]-+4H2O![]() [Fe(H2O)6]3++4Cl-得出此结论的理由是_______________________________________________________。
[Fe(H2O)6]3++4Cl-得出此结论的理由是_______________________________________________________。
【结论二】结论一中反应的ΔH________(填“>0”或“<0”)。
(5)实验小组同学重新设计了一个实验证明(4)中结论一。实验方案:取试管①中溶液,_______________________(请描述必要的实验操作和现象)。
查看答案和解析>>
科目: 来源: 题型:
【题目】科学家预言,燃料电池将是21世纪获得电能的重要途径。近几年开发的甲醇燃料电池是采用铂作电极催化剂,电池中的质子交换膜只允许质子和水分子通过。其工作原理的示意图如下:

请回答下列问题:
(1)Pt(a)电极是电池的________极,电极反应式为__________________;Pt(b)电极发生________(填“氧化”或“还原”)反应,电极反应式为___________。
(2)电池的总反应方程式为____________________。
(3)如果该电池工作时电路中通过2 mol电子,则消耗的CH3OH有______mol。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述中正确的是
A.除零族元素外,短周期元素的最高化合价在数值上都等于该元素所属的族序数
B.除短周期外,其他周期均有18个元素
C.副族元素中没有非金属元素
D.碱金属元素是指IA族的所有元素
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com