
科目: 来源: 题型:
【题目】从起始状态下A出发,在一定条件下可发生一系列变化,由图判断下列关系错误的是( )
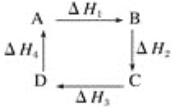
A. A→D,ΔH=-ΔH4
B. ΔH1+ΔH2+ΔH3+ΔH4=0
C. A→C,ΔH=ΔH3+ΔH4
D. |ΔH2+ΔH3|=|ΔH1+ΔH4|
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法中正确的是( )
A. 钡中毒患者可尽快使用苏打溶液洗胃,随即导泻使Ba2+转化为BaCO3而排出
B. 工业上可以用NaHS、(NH4)2S等可溶性硫化物作沉淀剂除去废水中的Hg2+
C. 水中的Mg(HCO3)2、Ca(HCO3)2受热易分解生成难溶性的MgCO3、CaCO3,故水垢的主要成分是MgCO3、CaCO3
D. 珊瑚虫从周围海水中获取Ca2+和![]() ,经反应形成石灰石(CaCO3)外壳,从而逐渐形成珊瑚
,经反应形成石灰石(CaCO3)外壳,从而逐渐形成珊瑚
查看答案和解析>>
科目: 来源: 题型:
【题目】某学习小组开展下列实验探究活动:
(1)装置A 中反应的化学方程式为___________________________。
(2)利用装置A 中产生的气体设计实验证明+4价硫具有氧化性:___________________________。
(3)选用下面的装置和药品探究亚硫酸与次氯酸的酸性强弱。

装置连接顺序为___________________________。通过___________________________现象即可证明亚硫酸的酸性强于次氯酸。
(4)利用G装置可测定装置A 液中SO2的含量。量取1.00 mL残液于烧瓶中,加适量的水稀释,加热使SO2全部逸出并与锥形瓶中H2O2完全反应(SO2+H2O2==H2SO4,然后用0.1000 mol/LNaOH 标准溶液进行滴定,至终点时消耗NaOH溶液20.00mL。
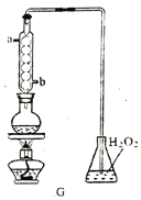
①残液中SO2含量为____________g·L-1
②经多次测定发现,测定值始终高于实验值,则其原因是___________________________。
(5)设计实验证明H2SO3为二元弱酸:___________________________。(可提供的仪器:pH计,其他中学化学常见仪器任选,药品:0.10mol·L-1NaOH溶液、0.05 mol·L-1H2SO3溶液,酸碱指示剂)
查看答案和解析>>
科目: 来源: 题型:
【题目】一些烷烃的燃烧热如下表:
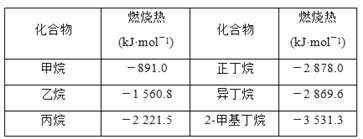
下列说法正确的是( )
A. 正戊烷的燃烧热大约是-3 540 kJ·mol-1
B. 热稳定性:正丁烷>异丁烷
C. 乙烷燃烧的热化学方程式为2C2H6(g)+7O2(g)=4CO2(g)+6H2O(g) ΔH=-1 560.8 kJ·mol-1
D. 相同质量的烷烃,碳的质量分数越大,燃烧放出的热量越多
查看答案和解析>>
科目: 来源: 题型:
【题目】关于1molL﹣1Na2SO4溶液的下列说法中,正确的是( )
A.溶液中含有1mol Na2SO4
B.1mol Na2SO4溶于1L水中
C.溶液中c(Na+)=2 molL﹣1
D.1L溶液中含有2molNa+ , 2mol SO42﹣
查看答案和解析>>
科目: 来源: 题型:
【题目】阿立呱陛(A)是一种新的抗精神分裂症药物,可由化合物B,C,D 在有机溶剂中通过以下两条路线合成得到。
A:
B:
线路一:![]()
线路二:![]()
(1)E的结构简式为______________,其含氧官能团有_________(写名称)。
(2)由C,D 生成化合物F 的反应类型是_____________。化合物C与足量的NaOH乙醇溶液共热反应的产物的名称是_________________。
(3)H 属于氨基酸,与B 的水解产物互为同分异构体。H 能与FeCl3溶液发生显色反应,且苯环上的一氯代物只有2 种。写出一种满足上述条件的H 的结构简式_________________。
(4)合成F (相对分子质量为366) 时还可能生成一种相对分子质量为285 的副产物G,G 能使溴水褪色,G 的结构简式为_________________。
(5)已知:  写出由C制备
写出由C制备 的合成路线流程图(无机试剂任选)。合成路线流程图示例如下:
的合成路线流程图(无机试剂任选)。合成路线流程图示例如下:
 _____________________
_____________________
查看答案和解析>>
科目: 来源: 题型:
【题目】图1是元素周期表的一部分,已知A、B、C、D、E、F、G都是周期表中的前四周期元素,它们在周期表中的位置如图1所示。

试回答下列问题:
(1)F元素基态原子的核外电子排布式为_________________。
(2)ABC的第一电离能由大到小的顺序______________(用元素符号表示)。
(3)B元素单质分子中的_______个π键,与其互为等电子体的阴离子为____________________。
(4)图2为A元素某种氧化物的晶胞,其分子中心原子采用________杂化,每个分子周围有_____个分子与之距离相等且最近。若晶胞棱长为apm,则该晶体密度的表达式为________g·cm-3。
(5)G元素的氢化物分子的空间构型为________,其沸点与B元素的氢化物相比________ (填高或低),其原因是________ 。
(6)向CuSO4溶液中滴加入B元素氢化物的水溶液,先生成蓝色沉淀,后沉淀逐渐溶解,得到深蓝色透明溶液,请写出沉淀溶解的离子方程式________ 。
(7)知道B的电负性大于氯,则B与F2或Cl2形成的化合物水解,产物是否相同__________?(填“相同”或“不同”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】聚合氯化铝是一种新型净水剂,其中铝的总浓度(用c表示)包括三类:主要为Al3+中的单体形态铝(用Ala表示)总浓度,主要为 [AlO4Al12(OH)24(H2O)12]7+的中等聚合形态铝总浓度(用Alb表示)和Al(OH)3胶体形态铝(用Alc表示)总浓度。
(1)真空碳热还原一氧化法可实现由铝土矿制备金属铝,相关反应的热化学方程式如下:
①Al2O3(s)+AlCl3(g)+3C(s)=3AlCl(g)+3CO(g) ΔH1=akJ·mol-1
②6AlCl(g)=4Al(s)+2AlCl3(g) ΔH2=bkJ·mol-1
则反应Al2O3(s) +3C(s)=2Al (s)+3CO(g) 说明ΔH=_______kJ·mol-1(用含a、b的代数式表示)。
_0( 填“>”或“<”)。
反应①在常压、1900℃的高温下才能进行,说明ΔH_______0(填“>”、“<”或“=”)
(2)用膜蒸馏(简称MD)浓缩技术将聚合氯化铝溶液进行浓缩,实验过程中不同浓度聚合氯化铝溶液中铝形态分布(百分数)如右表:
AlT/(mol·L-1) | Ala/% | Alb/% | A1c/% |
0.208 | 1.4 | 86.6 | 12.0 |
0.489 | 2.3 | 86.2 | 11.5 |
0.884 | 2.3 | 88.1 | 9.6 |
1.613 | 3.1 | 87.0 | 9.9 |
2.520 | 4.5 | 88.2 | 7.3 |
①在一定温度下,AlT越大,Al(OH)3胶体的百分含量________(填“越大”“越小”或“不变”)。
②若将c=2.520mol/L的聚合氧化铝溶液加水稀释,则稀释过程中发生的主要反应的离子方程式为_________________________________。
(3)一定条件下,向1.0mol/L的AlCl溶液中加入0.6mol/L的NaOH溶液,可制得Alb含量约为86% 的聚合氯化铝溶液。写出生成[AlO4Al12(OH)24(H2O)12]7+的离子方程式:_________________________。
(4)已知Al3++4X![]() 2
2![]() ,X表示显色剂,
,X表示显色剂,![]() 表示有色物质,通过比色分析得
表示有色物质,通过比色分析得
到25 ℃时Al3+浓度随时间的变化关系如图所示(初始时X的浓度为0.194 mol·L-1)。

①1min时, ![]() 的浓度为___________。
的浓度为___________。
②0~3min内该反应的速率vx=________。
③第9min时,反应达到平衡,K=__________(用代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】我国的纳米基础研究能力已跻身于世界前列,曾制得一种合成纳米材料,其化学式为RN(N为氮元素,且为-3价)。已知该化合物中的Rn+核外有28个电子,则R元素位于元素周期表的( )
A.第3周期第ⅤA族B.第4周期第ⅢA族
C.第5周期第ⅢA族D.第4周期第ⅤA族
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com