
科目: 来源: 题型:
【题目】应用 VSEPR 理论判断下表中分子或离子的立体构型。
分子 | 中心原子上弧电子对数 | 中心原子结合的杂化类型 | 分子或离子的立体构型 |
NH2 | _______________ | _______________ | _______________ |
BF3 | _______________ | _______________ | _______________ |
H3O+ | _______________ | _______________ | _______________ |
查看答案和解析>>
科目: 来源: 题型:
【题目】原子序数由小到大排列的四种短周期元素 X、Y、Z、W,四种元素的原子序数之和为 32,在周期表中 X 是原子半径最小的元素,Y、Z 左右相邻,Z、W 位于同主族。
(1)W 原子的核外电子排布式为__________________。
(2)均由 X、Y、Z 三种元素组成的三种常见物质 A.、B、C 分别属于酸、碱、盐,其化学式依次 为________________ 、__________________ 、____________________,推测盐中阴离子的空间构型为___________ ,其中心原子杂化方式为_________________________。
(3)Z、W 两种元素电负性的大小关系为___________ (填“大于”“等于”或“小于”);Y、Z 两种元素第 一电离能的大小关系为________________ (填“大于”“等于”或“小于”)。
(4)CO 的结构可表示为C≡O,元素Y 的单质Y2 的结构也可表示为Y≡Y。下表是两者的键能数据(单位:kJmol1):
AB | A═B | A≡B | |
CO | 357.7 | 798.9 | 1071.9 |
Y2 | 154.8 | 418.4 | 941.7 |
①结合数据说明 CO 比 Y2 活泼的原因:_________________________。
②意大利罗马大学 FulvioCacace 等人获得了极具研究意义的 Y4 分子,其结构如图所示,请结合上表数 据分析,下列说法中,正确的是_____。
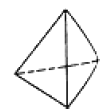
a. Y4 为一种新型化合物
b. Y4 与 Y2 互为同素异形体
c. Y4 的沸点比 P4(白磷)高
d. 1mol Y4 气体转变为 Y2 将放出 954.6kJ 热量
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)M2O7x- 与S2-在酸性溶液中发生如下反应:M2O7x- +3S2-+14H+=2M3++3S+7H2O,则x等于________ ,氧化产物与还原产物的物质的量比为_______。
(2)NaHSO4与Ba(OH)2在溶液中按物质的量之比为1:1混合反应的离子方程式_____;
(3)用单线桥标出该反应中电子转移的方向和数目________
Fe3O4 +4CO![]() 3Fe+4CO2
3Fe+4CO2
(4)过量CO2通入NaOH溶液中的离子方程式__________________;
查看答案和解析>>
科目: 来源: 题型:
【题目】NH4Cl和Ba(OH)2反应是一个吸热反应,在反应过程中
A. 核能转化成热能
B. 化学能转化成热能
C. 生成物的总能量等于反应物的总能量
D. 生成物的总能量大于反应物的总能量
查看答案和解析>>
科目: 来源: 题型:
【题目】已知高能锂离子电池的总反应式为2Li+FeS=Fe+Li2S,LiPF6·SO(CH3)2为电解质(Li+可自由通过),用该电池为电源电解含镍酸性废水并得到单质Ni,实验装置如图所示。下列说法正确的是( )
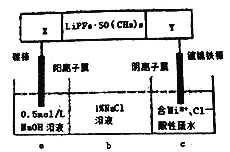
A. 电极X应为Li
B. 电解过程中,b中NaCl溶液的物质的量浓度将不断减小
C. X极反应式为FeS+2Li++2e-=Fe+Li2S
D. 若将图中阳离子膜去掉,将a、b两室合并,则电解反应总方程式不发生改变
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z、W、R是5种短周期元素,其原子序数依次增大。X是周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z、W、R处于同一周期,R与Y处于同一族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等。下列说法正确的是( )
A. 元素Y、Z、W形成的简单离子具有相同电子层结构,其半径依次增大
B. 元素Y、R分别与元素X形成的化合物的稳定性:XmY强于XmR
C. 元素Z、Y形成的1mol化合物中含有的分子数约为1.806×1024
D. 元素Z、R的最高价氧化物水化物之间相互反应生成的盐溶液呈中性或碱性
查看答案和解析>>
科目: 来源: 题型:
【题目】第四周期的 Cr、Fe、Co、Ni、Cu、Zn 等许多金属能形成配合物。
(1)NH3 是一种很好的配体,氨气分子是_____(填“极性”或“非极性”)分子,NH3 的沸 点_____(填“高于”“等于”或“低于”)AsH3。
(2)科学家通过 X 射线测得胆矾的结构示意图可简单表示如下:

图中虚线表示的作用力为_________________________。
(3)胆矾溶液与氨水在一定条件下可以生成 Cu(NH3)4SO4H2O 晶体。在 Cu(NH3)4SO4·H2O 晶体中,含 有的原子团或分子有:[Cu(NH3)4]2+、NH3、 SO42 、H2O,[Cu(NH3)4]2+为平面正方形结构,则 VSEPR 模型为四面体结构的原子团或分子是_____________,其中心原子的杂化轨道类型是________________ 。
(4)金属镍粉在 CO 气流中轻微加热,生成无色挥发性液态 Ni(CO)4,呈正四面体构型。Ni(CO)4 易溶于_____________________ (填编号)。
a . 水 b. 四氯化碳 c. 苯 d. 硫酸镍溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】取100 mL0.3mol/L和300 mL0.25mol/L的硫酸注入500 mL的容量瓶中,加水稀释至刻度线,则该混合液中H+的物质的量浓度为
A. 0.21mol/L B. 0.26mol/L C. 0.42mol/L D. 0.56mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com