
科目: 来源: 题型:
【题目】镍废料中主要含有Ni,还有少量的Cu、Fe、Pb等。现从中制取Ni2O3,可用于制造人造卫星、宇宙飞船的高能电池,也可用于制成镍镉碱性电池。生产流程见下:

已知0.010mol/L金属离子在不同pH下的沉淀情况如下:
Fe3+ | Cu2+ | Ni2+ | Fe2+ | |
开始沉淀pH | 3.0 | 5.0 | 7.4 | 9.7 |
完全沉淀pH | 4.0 | 6.5 | 9.0 | 11 |
回答下列问题:
(1)加入碳酸钙调pH的目的是____________________________________________,“沉渣2”的主要成分是____________,必须先过滤“沉渣1”后再进行“除Cu”的原因是______________________________________________________________________。
(2)用离子方程式解释加入NH4F“除Ca”的过程_________________。
(3)“酸浸”时参与反应的H2SO4与HNO3物质的量比保持为3∶2,此时Ni单质所发生的化学方程式为___________________________________________。
(4)“操作X”是__________、__________,煅烧时产生两种气体的成分是________。
(5)向NiO中加入盐酸溶解,待完全溶解后,加入足量NaOH溶液,再加入NaClO溶液,写出其中和NaClO相关的反应的离子方程式为_________________________________。
(6)根据上表数据,计算当0.010mol/LNiSO4溶液中Ni2+完全沉淀时的c(Ni2+)=______mol/L。
查看答案和解析>>
科目: 来源: 题型:
【题目】在标准状况下,将a LNH3完全溶于水得到V mL氨水,溶液的密度为ρg·cm-3,溶质的质量分数为ω,溶质的物质的量浓度为c mol/L。下列叙述中正确的是 ( )
A. ω=![]()
B. c=![]()
C. 上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5ω
D. 上述溶液中再加入同体积同浓度稀盐酸,充分反应后溶液中离子浓度大小关系为:c(Cl-)>c(NH4+)>c(OH-)>c(H+)
查看答案和解析>>
科目: 来源: 题型:
【题目】兴趣小组在实验室用制备的氯气与一氧化氮在常温常压下合成亚硝酰氯。
【查阅资料】亚硝酰氯(NOCl,熔点:-64.5℃,沸点:-5.5℃)是一种黄色气体,液体状态呈红褐色,遇水易水解。可用于合成清洁剂、触媒剂及中间体等。对眼睛、皮肤和粘膜有强烈刺激性,具有类似氯气和氮氧化物的毒作用。冰水中加入NaCl可降低温度。
【原料制备】在实验室分别制备原料气NO和Cl2。
(1)用如下装置制备纯净干燥的气体,请补充下表中各仪器中的试剂_______。
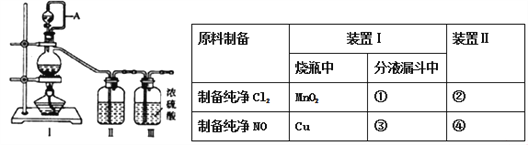
【合成亚硝酰氯】利用制得的NO和Cl2制备NOCl,装置如图所示:
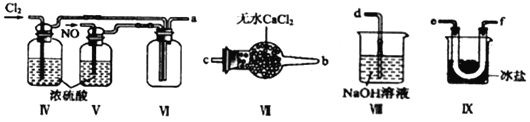
(2)装置Ⅳ、Ⅴ除可进一步干燥NO、Cl2外,另一个作用是___________________。
(3)装置连顺序为a→_______________(按气流自左向右方向,用小写字母表示)。
(4)装置Ⅶ的作用是___________________________________。
(5)装置Ⅸ在实验时,预期观察到的现象是__________________________________。
(6)装置Ⅷ中吸收尾气时,NOCl发生反应的化学方程式为________________________。
【拓展学习】
(7)查阅资料,得知配制王水(浓硝酸与浓盐酸的混酸)时会生成亚硝酰氯和氯气,该反应的化学方程式为__________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】根据下图海水综合利用的工艺流程图,判断下列说法正确的是 ( )

已知:MgCl2·6H2O受热生成Mg(OH)Cl和HCl气体等。
A. 过程①的提纯是物理过程
B. 在过程③中将MgCl2·6H2O灼烧即可制得无水MgCl2
C. 过程⑤反应后溶液呈强酸性,生产中需解决其对设备的腐蚀问题
D. 工业上采用向母液中加入烧碱的方法获得氢氧化镁
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应中,能证明SiO2是酸性氧化物的是( )
A.SiO2+2C═Si+2CO↑
B.SiO2+2NaOH═Na2SiO3+H2O
C.SiO2+4HF═SiF4↑+2H2O
D.SiO2+CaCO3═CaSiO3+CO2↑
查看答案和解析>>
科目: 来源: 题型:
【题目】在碱性溶液中能大量共存且溶液为无色透明的离子组是( )
A.K+、MnO4﹣、Na+、Cl﹣
B.K+、Na+、NO3﹣、CO32﹣
C.Na+、H+、NO3﹣、SO42﹣
D.Fe3+、Na+、Cl﹣、SO42﹣
查看答案和解析>>
科目: 来源: 题型:
【题目】下列表示对应化学反应的离子方程式正确的是 ( )
A. 向稀HNO3中滴加Na2SO3溶液: SO32-+2H+SO2↑+H2O
B. Na2CO3溶液中CO32-的水解:CO32-+H2O==HCO3-+OH-
C. 向Al2(SO4)3溶液中加入过量的NH3·H2O: Al3++4NH3·H2O[Al(OH)4]-+4N![]()
D. 向CuSO4溶液中加Na2O2:2Na2O2+2Cu2++2H2O4Na++2Cu(OH)2↓+O2↑
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)中国古代四大发明之一——黑火药,它的爆炸反应为:2KNO3 + 3C+S![]() A + N2↑+ 3CO2↑(已配平)
A + N2↑+ 3CO2↑(已配平)
①除S外,上列元素的电负性从大到小依次为_________。
②在生成物中,A的电子式________,含极性共价键的分子的中心原子轨道杂化类型为_____________。
③已知CN-与N2结构相似,推算HCN分子中σ键与π键数目之比为________。
(2)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T比Q多2。T的基态原子外围电子(价电子)排布为________,Q2+的未成对电子数是__________。
(3)在CrCl3的水溶液中,一定条件下存在组成为[CrCln(H2O)6-n]x+(n和x均为正整数)的配离子,将其通过氢离子交换树脂(R-H),可发生离子交换反应:[CrCln(H2O)6-n]x++xR-H→Rx[CrCln(H2O)6-n]x++xH+,交换出来的H+经中和滴定,即可求出x和n,确定配离子的组成。将含0.0015 mol [CrCln(H2O)6-n]x+的溶液,与R-H完全交换后,中和生成的H+需浓度为0.1200 mol·L-1NaOH溶液25.00 ml,可知该配离子的化学式为_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com