
科目: 来源: 题型:
【题目】有A、B、C、D、E 5种元素,它们的核电荷数依次增大,且都小于20,其中C、E是金属元素;A和E属同一族,且A为非金属元素,它们原子的最外层电子排布为ns1,B和D也属同一族,它们原子最外层的p能级电子数是s能级电子数的两倍。C原子最外层上电子数等于D原子最外层上电子数的一半。请回答下列问题:
(1)A是________,B是________,E是________(写元素符号)。
(2)写出C元素基态原子的电子排布式__________________________________。
(3)用轨道表示式表示D元素原子的价电子排布__________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)维生素C 又称“抗坏血酸”,在人体内有重要的功能。例如,能帮助人体将食物中摄取的不易吸收的Fe3+转变为易吸收的Fe2+,这说明维生素C 具有______性。(填氧化性或还原性)
(2)我国古代四大发明之一的黑火药是由硫磺粉、硝酸钾和木炭粉按一定比例混合而成,爆炸时的反应为:S+2KNO3+3C=K2S+N2↑+3 CO2↑。该反应的氧化剂是____,当16g 硫参加反应时,转移的电子数为__________。
(3)饮用水中的NO3-对人类健康会产生危害,为了降低饮用水中NO3-的浓度,某饮用水研究人员提出,在碱性条件下用铝粉将NO3-还原为N2,其化学方程式为:10Al+6NaNO3+4NaOH=10NaAlO2+3N2↑+2H2O。上述反应中,若有10个铝原子参与反应,则转移的电子数为__________个,用“双线桥法”标明反应中电子转移的方向和数目_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室制Cl2反应为4HCl(浓)+MnO2![]() MnCl2+Cl2↑+2H2O下列说法不正确的是
MnCl2+Cl2↑+2H2O下列说法不正确的是
A. 还原剂是HCl,氧化剂是MnO2
B. 每生成1 mol Cl2,转移的电子数为2 NA
C. 转移电子的物质的量为1 mol时,生成标准状况下Cl2的体积为11.2 L
D. 每消耗1 mol MnO2,起还原剂作用的HCl消耗4 mol
查看答案和解析>>
科目: 来源: 题型:
【题目】铜及其化合物在科学研究和工业生产中具有许多用途。请回答下列问题:
(1)Cu2O中阳离子的基态核外电子排布式为__________________; Cu和Ni在元素周期表中的位置相邻, Ni在周期表中的位置是__________________。
(2)将过量的氨水加到硫酸铜溶液中,溶液最终变成深蓝色,继续加入乙醇,析出深蓝色的晶体 [Cu( NH3)4]SO4·H2O。
①乙醇分子中C 原子的轨道杂化类型为__________________,NH3与H+以配位键形成NH4+,则NH4+的空间构型为____________________。
②[Cu( NH3)4]SO4·H2O]中存在的化学键除了极性共价键外,还有____________________。
③NH3极易溶于水的原因主要有两个,一是_______________,二是_______________________。
(3)CuSO4溶液中加入过量KCN溶液能生成配离子[Cu(CN)4]2-,1mol CN-中含有的π键数目为__________。与CN-互为等电子体的离子有____________(写出一种即可)。
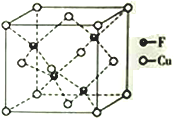
(4)Cu 与F形成的化合物的晶胞结构如图所示,若晶体密度为a g·cm-3,则Cu与F最近距离为____________pm(用NA表示阿伏加德罗常数的值,列出计算表达式,不用化简)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述错误的是
A. 5LCH4气体与5LNH3气体的原子个数之比为5:4
B. 常温常压下,11.2LO3中所含氧原子个数小于1.5NA
C. 同温、同压下,相同体积的N2和CO气体具有相同的分子数和相同的密度
D. 同温、同压下,等质量的一氧化碳和二氧化碳的密度比为7:11
查看答案和解析>>
科目: 来源: 题型:
【题目】将50g溶质质量分数为w1,物质的量浓度为c1 的较浓氨水沿玻璃棒加人到u mL水中,稀释后得到溶质质量分数为w2,物质的量浓度为c2的稀氨水。若c1 =2c2,则:
A. w1>2w2,u>50 B. w1<2w2,u<50 C. w1=2w2,u<50 D. w1<2w2,u>50
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com