
科目: 来源: 题型:
【题目】质子核磁共振谱是研究有机化合物结构的有力手段之一。结构中的等效氢原子核磁共振谱中都给出了相应的峰值(信号),谱中峰的强度与结构中的H原子数成正比。试回答:
(1)结构简式为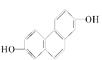 的有机化合物,在核磁共振谱中观察峰给出的强度之比为___________。
的有机化合物,在核磁共振谱中观察峰给出的强度之比为___________。
(2)实践中可根据核共振谱上观察到H原子给出的峰值情况,确定有机化合物的结构。分子式为C3H6O2的链状有机化合物核磁共振谱上峰给出的稳定强度仅有四种,它们分别是①3∶3,②3∶2∶1,③3∶1∶1∶1,④1∶2∶2∶1。
请分别推断出其对应的结构简式:
①________________________; ② ___________________________;
③________________________; ④ ___________________________。
(3)测得CH3CH2CH2CH3化合物核磁共振谱上可观察到两种峰,而CH3CH=CHCH3的核磁共振谱有4种峰,结合其空间结构 ,解释产生4个峰的原因:_______________。
,解释产生4个峰的原因:_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度时,将2molCO与5molH2的混合气体充入容积为2L的密闭容器中,在催化剂的作用下发生反应:CO(g)+2H2(g)![]() CH3OH(g)。
CH3OH(g)。
(1)经过5min后,反应达到平衡,此时转移电子6mol。该反应的平衡常数为_______。V(H2)=_____mol/(L·min)。若保持体积不变,再充入2mulCO和1.5mol CH3OH,此时v(正)___ v(逆)(填“>”“<”或“=”)。
(2)在其他条件不变的情况下,再增加2molCO与5molH2,达到新平衡时,CO的转化率____(填“增大”“减小”或“不变”)。
(3)下列不能说明该反应已达到平衡状态的是__________
a.CH3OH的质量不变 b.混合气体的平均相对分子质量不再改变
c.V逆(CO)=2V正(H2) d.混合气体的密度不再发生改变
(4)在一定压强下,容积为VL的容器充入amolCO与2amolH2,在催化剂作用下反应生成甲醇,平衡转化率与温度、压强的关系如图所示。
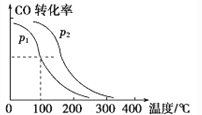
则p1_____p2(填“大于”“小于”或“等于”,下同),△H_____0。该反应在_______(填“高温”或“低温”)下能自发进行。
(5)能使该反应的反应速率增大,且平衡向正反应方向移动的是_____。
a.及时分离除CH3OH气体 b.适当升高温度
c.增大H2的浓度 d.选择高效催化剂
(6)下面四个选项是四位学生在学习化学反应速率与化学反应限度以后,联系化工生产实际所发表的看法,你认为不正确的是_______。
a.化学反应速率理论可指导怎样在一定时间内快出产品
b.有效碰撞理论可指导怎样提高原料的转化率
c.勒夏特列原理可指导怎样使用有限原料多出产品
d.正确利用化学反应速率和化学反应限度都可以提高化工生产的综合经济效益
查看答案和解析>>
科目: 来源: 题型:
【题目】用混有硫酸亚铁和硫酸镁等杂质的锰矿(含MnO2、MnCO3)生产硫酸锰,实验室模拟生产过程如下:
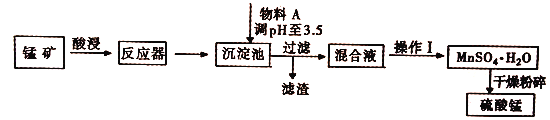
(完全沉淀离子的pH值:Fe3+为3.5,Fe2+为9.5,Mn2+为10.8,Mg2+为11.6)
(1)酸浸中加入的酸是________(填化学式,下同),提高酸浸速率的方法是____(任写一种),从经济效益考虑,物料A可能是___________。
(2)反应器中发生氧化还原反应的离子方程式是___________________ 。
(3)硫酸锰和硫酸镁的溶解度曲线如图所示:
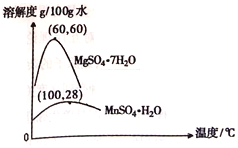
①操作I为:在_____℃下蒸发结晶、趁热过滤。其趁热过滤目的是__________;
②为了得到更纯净的一水合硫酸锰,需将晶体置于过滤器中,用_____进行洗涤(本空格从以下选择)
a.蒸馏水 b.稀硫酸 c.饱和硫酸锰溶液 d.氢氧化钠溶液
(4)MnSO4·H2O在1150℃高温下易分解,产物是Mn304、含硫化合物、水,在该条件下硫酸锰晶体分解反应的化学方程式是___________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知某种燃料含有碳、氢、氧三种元素。为了测定这种燃料中碳和氢两种元素的质量比,可将气态燃料放入足量的O2中燃烧,并将产生的气体全部通过如图所示装置,得到如下表所列的实验结果(假设产生的气体完全被吸收)。

实验前 | 实验后 | |
干燥剂和U形管的质量 | 101.1 g | 102.9 g |
石灰水和广口瓶的质量 | 312.0 g | 314.2 g |
根据实验数据填空:
(1)实验完毕后,生成物中水的质量为________ g,假设广口瓶里生成一种正盐,其质量为________ g。
(2)生成的水中氢元素的质量为________ g。
(3)生成的CO2中碳元素的质量为________ g。
(4)该燃料中碳、氢元素的质量比为________。
(5)已知这种燃料的每个分子中含有一个氧原子,则该燃料的分子式为________,结构简式为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有机反应的产物中不可能存在同分异构体的是( )
A. CH3CH=CH2与HCl加成
B. CH3CH2CH2Cl在碱性溶液中水解
C. CH2=CH—CH=CH2与H2按物质的量之比为1∶1进行反应
D. ![]() 与NaOH的醇溶液共热
与NaOH的醇溶液共热
查看答案和解析>>
科目: 来源: 题型:
【题目】某NaOH样品中含有少量Na2CO3、NaHCO3和H2O,经分析测定,其中含NaOH83.4%(质量分数,下同), NaHCO3 8.8%,Na2CO3 6.4%,H2O 1.4%。将此样品若干克投入到49克21%的稀硫酸中,待反应完全后,需加入20克9.0%的NaOH溶液方能恰好中和。则蒸发中和后的溶液可得固体质量接近于
A. 25 B. 20 C. 15 D. 10
查看答案和解析>>
科目: 来源: 题型:
【题目】在b L Al2(SO4)3和(NH4)2SO4的混合溶液中加入a mol BaCl2,恰好使溶液中的SO42-﹣离子完全沉淀;如加入足量强碱并加热可得到c mol NH3,则原溶液中的Al3+浓度(mol/L)为
A. (2a-c)/b B. (2a-c)/2b C. (2a-c)/3b D. (2a-c)/6b
查看答案和解析>>
科目: 来源: 题型:
【题目】下表为元素周期表的一部分。
碳 | 氮 | Y | |
X | 硫 | Z |
回答下列问题:
(1)Z元素在周期表中的位置为_______________。
(2)下列事实能说明Y元素的非金属性比硫元素的非金属性强的是___________。
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1molY单质比1mol硫得电子多
c.Y和硫两元素的简单氢化物受热分解,前者的分解温度高
(3)X与Z两元素的单质反应生成1molX的最高价化合物,恢复至室温,放热687kJ。已知该化合物的熔、沸点分别为-69℃和58℃。写出该反应的热化学方程式:_____________。
(4)1mol碳与镁形成的化合物Q与4mo水反应,生成2molMg(OH)2和1mol烃,该烃分子中碳氢质量比为9:1,烃的电子式为____________。
(5)Q与水反应的化学方程式为_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com