
科目: 来源: 题型:
【题目】在t℃时,AgBr在水中的沉淀溶解平衡曲线如图所示。又知t℃时AgCl的Ksp=4×10-10,下列说法不正确的是

A. 在t℃时,AgBr的Ksp为4.9×10-13
B. 在AgBr饱和溶液中加入NaBr固体,可使溶液由c点到b点
C. 图中a点对应的是AgBr的不饱和溶液
D. 在t℃时,AgCl(s)+Br-(aq)![]() AgBr(s)+Cl-(aq)平衡常数K≈816
AgBr(s)+Cl-(aq)平衡常数K≈816
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z、W为原子序数依次增大的四种短周期主族元素,其中X、Z同主族,Y原子的最外层电子数为次外层电子数的一半,X原子的最外层电子数是其核外电子层数的3倍。下列说法不正确的是
A. 最简单气态氢化物的热稳定性,W>Z>Y B. 单质的沸点:Y>X>Z
C. 简单离子半径:Z>W>X D. X的氢化物中可能含有非极性共价键
查看答案和解析>>
科目: 来源: 题型:
【题目】聚乙二醇(PEG) 是一种用途广泛的聚合物,1,2-乙二醇碳酸酯(又称为碳酸亚乙酯) 是一种医药中间体。某小组以烃A 为原料合成PEG和碳酸亚乙酯的路线设计如下:
已知: 2C2H5OH+CO+1/2O2 ![]() C2H5OCOOC2H5+H2O
C2H5OCOOC2H5+H2O
回答下列问题:
(1)A的名称为____________; A→B的反应类型为__________;C 的核磁共振氢谱中峰面积比为___________;F的分子式为____________________。
(2)B→C的化学方程式为____________。
(3)C在一定条件下发生聚合反应生成PEC,化学方程式为___________________;若某种PEG的平均相对分子质量为2000, 则其平均聚合度为____________________。
(4)E的同分异构体中,含有—OCOO—基团的共有___种(不包含E和立体异构)。
(5)有人认为C和E生成F的反应历程可能如下:
①HOCH2CH2OH + CO32-![]() HOCH2CH2O-+HCO3-
HOCH2CH2O-+HCO3-
②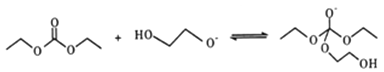
③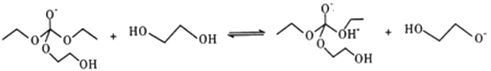
④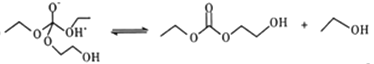
⑤
⑥⑦⑧……
⑨HOCH2CH2O- +HCO3-→HOCH2CH2OH+CO32-
写出上述历程中⑥⑦⑧的反应方程式___________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】铝具有较强的抗腐蚀能力(即耐腐蚀)的主要原因是
A. 铝化学性质很稳定(即很不活泼) B. 铝与氧气在常温下很难反应
C. 铝是两性元素(因与酸、碱都能反应) D. 铝易氧化形成一层致密氧化膜
查看答案和解析>>
科目: 来源: 题型:
【题目】将下图所示实验装置的 K 闭合,下列判断正确的是

A. Cu电极上发生还原反应 B. 电子沿 Zn→a→b→Cu路径流动
C. 片刻后甲池中c(SO![]() )增大 D. 片刻后可观察到滤纸b点变红色
)增大 D. 片刻后可观察到滤纸b点变红色
查看答案和解析>>
科目: 来源: 题型:
【题目】硫单质及其化合物在化工生产、污水处理等领域应用广泛。
(1)煤制得的化工原料气中含有羰基硫(O=C=S),该物质可转化为H2S,主要反应如下:
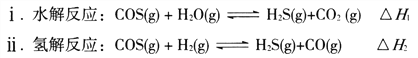
已知反应中相关的化学键键能数据如下表:
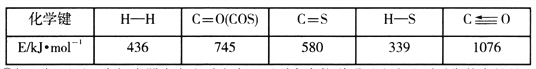
①一定条件下,密闭容器中发生反应i,其中COS(g)的平衡转化率(![]() )与温度(T)的关系如图所示。则A、B、C三点对应的状态中,v(COS)=v(H2S)的是____________。(填标号)
)与温度(T)的关系如图所示。则A、B、C三点对应的状态中,v(COS)=v(H2S)的是____________。(填标号)
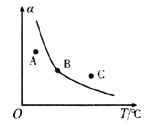
②反应ii的正、逆反应的平衡常数(K)与温度(T)的关系如图所示,其中表示逆反应的平衡常数(K逆)的是__________(填“A”或“B”)。T1℃时,向容积为10 L的恒容密闭容器中充入2 mol COS(g)和1 mol H2(g),发生反应ii,COS的平衡转化率为_____________。
(2)过二硫酸是一种强氧化性酸,其结构式为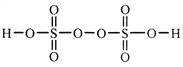
①在Ag+催化作用下,S2O82-能与Mn2+在水溶液中发生反应生成SO42-和MnO4-,该反应的离子方程式为________________________。
②工业上可用惰性电极电解硫酸和硫酸铵混合溶液的方法制备过二硫酸铵。总反应的离子方程式为________________________________。
(3)NaHS可用于污水处理的沉淀剂。已知:25℃时,反应Hg2+(aq)+HS-(aq) ![]() HgS(s)+H+(aq)的平衡常数K=1.75×1038,H2S的电离平衡常数Ka1=1.0×10-7,Ka2=7.0×10-15。
HgS(s)+H+(aq)的平衡常数K=1.75×1038,H2S的电离平衡常数Ka1=1.0×10-7,Ka2=7.0×10-15。
①NaHS的电子式为____________________。②Ksp(HgS)=_____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是探究过氧化氢酶量对酶促反应速率影响的实验装置图,请回答下列问题:
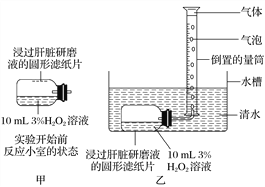
(1)本实验中对自变量的控制可通过________________________来实现。除了自变量和因变量外,本实验中无关变量是(答出主要两点)__________________。
(2)若要验证酶的专一性,在此实验装置的基础上,应如何改进(请写出具体的措施)?
______________________________________________________________。
(3)能否用本实验装置来验证温度对酶活性的影响?____________,原因是__________________________。
(4)在过氧化氢溶液相同浓度、相同体积的不同实验组中加入大小相同不同数目的浸过肝脏研磨液的滤纸片,则几个实验组最终生成的气体量是否相同__________,原因是______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com