
科目: 来源: 题型:
【题目】类推是一种重要的学习方法,但如果不具体问题具体分析就会得出错误结论。下列类推结论正确的是
A. SiH4的熔沸点比CH4高,则PH3的熔沸点比NH3高
B. Al(OH)3能溶于NaOH溶液,则Be(OH)2能溶于NaOH溶液
C. 钠在空气中燃烧生成过氧化钠,则锂在空气中燃烧生成过氧化锂
D. F2在暗处遇H2即爆炸,I2在暗处遇H2爆炸
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室制备氨基甲酸铵(NH2COONH4)的反应如下:2NH3(g)+CO2(g)![]() NH2COONH4(s)。该反应在干燥条件下仅生成氨基甲酸铵,若有水存在则生成碳酸铵或碳酸氢铵。
NH2COONH4(s)。该反应在干燥条件下仅生成氨基甲酸铵,若有水存在则生成碳酸铵或碳酸氢铵。
(1)该反应在一定条件下能够自发进行,则反应的ΔH________0。(填大于、小于或等于)
(2)写出生成碳酸氢铵的化学方程式________。
(3)实验步骤如下:

步骤1:按图所示组装仪器,检查装置气密性。
步骤2:在相应仪器中装入药品,其中在三颈烧瓶中加入氢氧化钠固体,恒压滴液漏斗中装入浓氨水。
步骤3:滴加浓氨水并搅拌,调节反应速率,在反应器中得到产品
……
①干燥管中盛放的药品是_________。
②对比碳酸盐和酸反应制CO2,该实验利用干冰升华产生CO2气体的优点有______,_______。
③以恒压滴液漏斗代替分液漏斗的目的是________________。
④反应后期CO2气流量下降时,可采取的相应措施是______________。
(4)该实验装置中可能存在的缺陷是____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在自来水的生产中,常通入适量氯气进行杀菌消毒,氯气与水反应的产物之一是盐酸。市场上有些不法商贩为牟取暴利,利用自来水冒充纯净水桶装出售。为辨别真伪,可用下列哪一种试剂来鉴别( )
A.酚酞试液B.氯化钡溶液C.氢氧化钠溶液D.硝酸银溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】H、C、N、O、F、Ca是六种重要的元素请根据所学的物质结构与性质的4机关知识下列问题:
(1)基态碳原子的电子排布式为__,O和F形成的化合物中原子价层都满足8电子结构的结构式是__,O元素的化合价为________.
(2)Ca在燃烧时产生红色火焰,其焰色反应看见的光属于__(填“吸收”或“发射”)光谱。
(3)某药物的结构简式为![]() ,财该物质中氮原子的杂化轨道类型为____,其分子之间__(填“能”或“不能”)形成氢键。
,财该物质中氮原子的杂化轨道类型为____,其分子之间__(填“能”或“不能”)形成氢键。
(4)CO2属于_____(填“极性”或”非极性”)分子。CO32-的空间构型为_____,与其互为等电子体的分子和离子分别为_________(各写一种)。
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,向0.1mol/LNH3·H2O溶液中通入HCl气体,溶液中![]() 与pOH(仿pH定义)的关系如图所示。下列有关叙述正确的是
与pOH(仿pH定义)的关系如图所示。下列有关叙述正确的是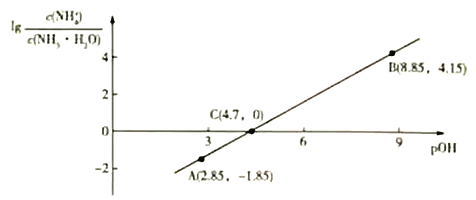
A. C点的溶液中:c(NH3·H2O)>c(NH4+)
B. pOH=7的客液中的溶质是NH4Cl
C. pOH=3的客液中:c(NH4+)+c(H+)+c(NH3·H2O)-c(OH-)=0.1mol/L
D. NH3·H2O的Kb=1.0×10-4.7
查看答案和解析>>
科目: 来源: 题型:
【题目】通过CO传感器可监测CO的含量,总反应为2K2FeO4+3CO+2KOH+2H2O=2Fe(OH)3+3K2CO3,其工作原理示意图如下,下列说法正确的是
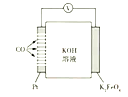
A. 电极为负极,可以用Fe电极代替
B. 工作时OH-向K2FeO4电极移动
C. 每转化3molCO,有2molK2FeO4被氧化
D. K2FeO4电极上的电极反应式是2FeO42-+8H2O+6e-=2Fe(OH)3↓+10OH-
查看答案和解析>>
科目: 来源: 题型:
【题目】对机动车尾气中的N元素、C 元素进行处理,可以保护环境,减少污染。
(1)汽缸中生成 NO 的反应为:N2(g)+O2(g) ![]() 2NO(g) △H>0,NOx在铑(Rh)的催化下最终转化为无毒的产物,其中NO与CO的反应过程中经历如下两步(已知:1kcal=4.18kJ):
2NO(g) △H>0,NOx在铑(Rh)的催化下最终转化为无毒的产物,其中NO与CO的反应过程中经历如下两步(已知:1kcal=4.18kJ):
反应Ⅰ:NO(g)+CO(g)+Rh(s)![]() RhN(s)+CO2(g) △H=-8kcal·mol-1
RhN(s)+CO2(g) △H=-8kcal·mol-1
反应Ⅱ:RhN(s)+NO(g)![]() Rh(s)+N2O(g) △H =-76.4kcal·mol-1
Rh(s)+N2O(g) △H =-76.4kcal·mol-1
则由NO生成1mol N2O的△H =____kcal·mol-1。若Ⅰ比Ⅱ的反应速率大,下列能正确表示反应2NO(g)+CO(g)![]() N2O(g)+CO2(g) △H在有催化剂(a)和无催化剂(b)时反应进程的能量变化图的是_____
N2O(g)+CO2(g) △H在有催化剂(a)和无催化剂(b)时反应进程的能量变化图的是_____

⑵在体积为1L的恒温密闭容器中,发生反应:
2NO(g)+2CO (g) ![]() N2(g)+2CO2(g),有关物质的量如下表:
N2(g)+2CO2(g),有关物质的量如下表:
起始物质的量/mol | 平衡物质的量/mol | |||
NO | CO | N2 | CO2 | CO2 |
0.2 | 0.2 | 0 | 0 | a |
①上述反应的化学平衡常数表达式K=__________
②若达到平衡后气体的压强为开始时的0.875倍,则a =______
⑶汽车使用乙醇汽油并不能减少NOx的排放,某研究小组在实验室以耐高温试剂Ag-ZSW-5催化,测得NO转化为N2的转化率随温度变化情况如下图所示。
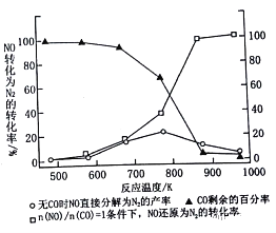
①在n(NO)/n(CO)=1条件下,最佳温度应控制在_____左右。
②若不使用CO,温度超过775 K,发现NO的分解率降低,其可能的原因为___
③用平衡移动原理解释为什么加入CO后NO转化为N2的转化率增大?______
查看答案和解析>>
科目: 来源: 题型:
【题目】如图表示电解质溶液波燕面水中的c(H+)与c(OH-)在不同温度下的关系曲线,关于由A点到B点的变化,下列说法正确的是

A. 对Ba(OH)2溶液升高温度
B. 对NaCl溶液降低温度
C. 对H2SO4溶液降低温度
D. 对蒸馏水升高温度
查看答案和解析>>
科目: 来源: 题型:
【题目】利用工业冶炼硫酸铜(含有Fe2+、AsO2-、Ca2+等杂质)提纯制备电镀硫酸铜的生产流程如下:

已知:①Fe3+、Cu2+开始沉淀的pH分别2.7、5.4,完全沉淀的pH分别为3.7、6.4。
②Ksp[Cu(OH)2]=2×10-20
③AsO2-+H2O2+H+=H3AsO4, H3AsO4+Fe3+=FeAsO4↓+3H+
(1)溶解操作中需要配制含铜32 g·L-1的硫酸铜溶液1.0 L,需要称量冶炼级硫酸铜的质量至少为___________g。
(2)测定溶解液中的Fe2+的浓度,可用KMnO4标准溶液滴定,取用KMnO4溶液应使用
________(“酸式”或“碱式”)滴定管,其中反应离子方程式为:______________________。若要检验调节pH后溶液中的Fe3+已除尽的方法是___________________________。
(3)氧化后需要将溶液进行稀释及调节溶液的pH=5,则稀释后的溶液中铜离子浓度最大不能超过____________mol·L-1。
(4)固体Ⅰ的主要成分除 FeAsO4 、Fe(OH)3外还有__________________,由溶液Ⅰ获得CuSO4·H2O,需要经过________ 、____________、过滤、洗涤、干燥操作。
(5)利用以上电镀级硫酸铜作为电解质溶液,电解粗铜(含锌、银、铂杂质)制备纯铜,写出阳极发生的电极反应式:________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com