
科目: 来源: 题型:
【题目】把下列四种X溶液分别迅速加入四个盛有10 mL 2 mol·L-1盐酸的烧杯中,此时,X和盐酸立刻进行反应,其中初始反应速率最快的是
A. 10℃ 10 mL 3 mol·L-1的X溶液 B. 20℃ 10 mL 2 mol·L-1的X溶液
C. 20℃ 10 mL 4 mol·L-1的X溶液 D. 10℃ 10 mL 2 mol·L-1的X溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】次磷酸(H3PO2)是一种精细磷化工产品,具有较强还原性,回答下列问题:
(1)H3PO2是一元中强酸,写出其电离方程式 。
(2)H3PO2及NaH2PO2均可将溶液中的Ag+还原为银,从而可用于化学镀银。
①H3PO2中,P元素的化合价为 。
②利用H3PO2进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4:1,则氧化产物为 (填化学式)。
③NaH2PO2为 (填“正盐”或“酸式盐”)
(3)H3PO2的工业制法是:将白磷(P4)与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2,后者再与H2SO4反应。写出白磷与Ba(OH)2溶液反应的化学方程式: 。
查看答案和解析>>
科目: 来源: 题型:
【题目】
我国科学家最近成功合成了世界上首个五氮阴离子盐(N5)6(H3O)3(NH4)4Cl(用R代表)。回答下列问题:
(1)氮原子价层电子对的轨道表达式(电子排布图)为_____________。
(2)元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能(E1)。第二周期部分元素的E1变化趋势如图(a)所示,其中除氮元素外,其他元素的E1自左而右依次增大的原因是___________;氮元素的E1呈现异常的原因是__________。
(3)经X射线衍射测得化合物R的晶体结构,其局部结构如图(b)所示。
①从结构角度分析,R中两种阳离子的相同之处为_________,不同之处为__________。(填标号)
A.中心原子的杂化轨道类型 B.中心原子的价层电子对数
C.立体结构 D.共价键类型
②R中阴离子N5-中的σ键总数为________个。分子中的大π键可用符号![]() 表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如苯分子中的大π键可表示为![]() ),则N5-中的大π键应表示为____________。
),则N5-中的大π键应表示为____________。
③图(b)中虚线代表氢键,其表示式为(NH4+)N-H┄Cl、____________、____________。

(4)R的晶体密度为d g·cm-3,其立方晶胞参数为a nm,晶胞中含有y个[(N5)6(H3O)3(NH4)4Cl]单元,该单元的相对质量为M,则y的计算表达式为______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】MnO2是一种重要的无机功能材料,粗MnO2的提纯是工业生产的重要环节。某研究性学习小组设计了将粗MnO2 (含有较多的MnO 和MnCO3) 样品转化为纯MnO2的实验,其流程如下:
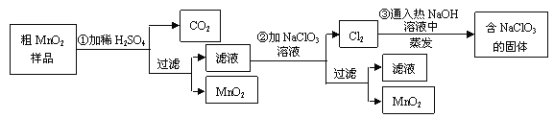
(1)第①步加稀H2SO4时,粗MnO2样品中的________(写化学式)转化为可溶性物质。
(2)第②步反应的离子方程式:___________________________________。
(3)第③步蒸发操作必需的仪器有铁架台(含铁圈)、______、______、______,己知蒸发得到的固体中有NaClO3 和NaOH,则一定还有含有________(写化学式)。
(4)若粗MnO2样品的质量为12.69g,第①步反应后,经过滤得到8.7g MnO2,并收集到0.224LCO2 (标准状况下),则在第②步反应中至少需要___molNaClO3。
查看答案和解析>>
科目: 来源: 题型:
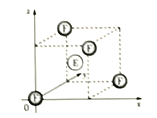
【题目】A为短周期元素,A-F6种元素在元素周期表中的位置如图所示,其中A的基态原子的能层序数与最外基电子数相等。回答下列问题(请用元素符号表示相关化学式):

(1)F的价电于排布式为_______________。
(2)B、C、D原子的电负性由大到小的顺序是_______________。
(3)化合物BE2微溶于水,为______(填“极性“成“非极性”)分子,BE2______ (填“能”或“不能”)分离常见的B的单质和正的单质的混合物。
(4)下图为FE晶胞的一部分,F原子的周围最近的E原子有__个;若FE晶胞参数为a,作为数轴单位,在坐标原点的F原于坐标参数记为(0,0,0),则图中E原子的坐标参数为____。
查看答案和解析>>
科目: 来源: 题型:
【题目】对于化学反应方向的确定不仅与焓变(ΔH)有关,也与温度(T)、熵变(ΔS)有关,实验证明,化学反应的方向应由ΔH-TΔS确定,若ΔH-TΔS<0,则自发进行,否则不能自发进行。下列说法中,正确的是( )
A.在温度、压强一定的条件下,焓因素和熵因素共同决定一个化学反应的方向
B.温度、压强一定时,熵增加的反应一定能自发进行
C.反应焓变是决定反应能否自发进行的唯一因素
D.固体的溶解过程只与焓变有关
查看答案和解析>>
科目: 来源: 题型:
【题目】已知化合物C为中学常见的化合物。

(1)若D是一种强酸,则C与水反应的化学方程式为__________________________。
有人认为“浓H2SO4可以干燥气体C”,某同学为了验证该观点是否正确,用如右上图装置进行实验。分液漏斗中应加入_______________,打开分液漏斗进行实验,过程中,浓H2SO4中未发现有气体逸出,且变为红棕色,则你得出的解释和结论是__________________。
(2)若D是一种常见的强碱,则C的电子式为:_______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知X、Y、Z、M、G、Q是六种短周期主族元素,原子序数依次增大。X、Z、Q的单质在常温下呈气态,Y的原子最外层电子数是其电子层数的2倍,X与M同主族,Z的气态氧化物能与其最高价氧化物的水化物反应,G是地壳中含量最高的金属元素。清回答下列问题:
(1)Q的元素符号为______,Y、Z、M、G四种元素原子半径由大到小的顺序是(写元素符号)___________。
(2)Y在元素周期表中的位置为_______________,Y与硫元素形成的二元化合物的电子式为_________________________。
(3)上述元素的最高价氧化物对应的水化物酸性最强的是(写化学式)____________________。
(4)单质Y和元素Z的最高价氧化物对应水化物的浓溶液发生反应的化学方程式为_________。
(5)Z和G组成的化合物GZ,被大量用于制造电子元件。工业上用G的氧化物、Y单质和Z单质在高温下制备GZ,其中G的氧化物和Y单质的物质的量之比为1:3,则该反应的化学方程式为__________________________。
(6)常温下,不能与G的单质发生反应的是(填序号)_________________________。
a.CuSO4溶液 b.Fe2O3 c.浓硫酸 d.NaOH溶液 e.Na2CO3固体
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法不正确的是
A. 储热材料是一类重要的存储物质,单位质量的储热材料在发生熔融或结晶时会吸收或释放较大的热量
B. Ge(32号元素)的单晶可以作为光电转换材料用于太阳能电池
C. 纳米铁粉可以高效地去除被污染水体中的Pb2+,Cu2+,Cd2+,Hg2+等重金属离子,其本质是纳米铁粉对重金属离子较强的物理吸附
D. Ba2+浓度较高时危害健康,但BaSO4可服入体内,作为造影剂用于X-射线检查肠胃道疾病
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com