
科目: 来源: 题型:
【题目】氮及其化合物在工业生产和国防建设中有广泛应用。回答下列问题:
(1)氮气性质稳定,可用作保护气。请用电子式表示氮气的形成过程:______。
(2)联氨(N2H4)是一种还原剂,能与氧气反应生成氮气和水蒸气。试结合下表数据,写出在该反应的热化学方程式:____________________________。
化学键 | N—H | N—N | N=N | N≡N | O=O | O—H |
键能(kJ/mol) | 390.8 | 193 | 418 | 946 | 497.3 | 462.8 |
(3)氨的催化氧化用于工业生产硝酸。该反应可设计成新型电池,试写出碱性环境下,该电池的负极电极反应式:__________________________。
(4)常温下用氨水吸收CO2可得利(NH4)2CO3溶液,在(NH4)2CO3溶液中,c(OH-)_________c(H+)(填“>”“<”或“=”);反应NH4++CO32-+H2O![]() NH3·H2O+HCO3-的平衡常数K=______(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数Ka1=4×10-7,Ka2=4×10-11)
NH3·H2O+HCO3-的平衡常数K=______(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数Ka1=4×10-7,Ka2=4×10-11)
(5)将某浓度的NO2气体充入一恒容绝热容器中,发生反应2NO2![]() N2O4其相关图像如下。
N2O4其相关图像如下。
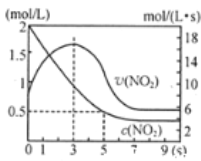
①0~3s时v(NO2)增大的原因是_________。
②5s时NO2转化率为__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】高纯碳酸锰在电子工业中有重要的应用,湿法浸出软锰矿主要成分为MnO2,含少量Fe、Al、Mg等杂质元素)制备高纯碳酸锰的实验过程如下:
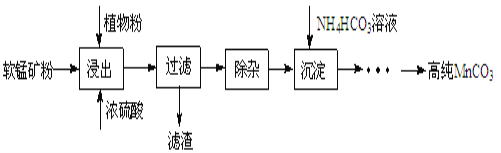
(1)浸出:浸出时温度控制在90℃~95℃之间,并且要连续搅拌3小时,植物粉的作用是_____。
(2)除杂:①向浸出液中加入一定量的碳酸锰矿,调节浸出液的pH为3.5~5.5;
②再加入一定量的软锰矿和双氧水,过滤;
③…
操作①中使用碳酸锰调pH的优势是_____;
操作②中加入双氧水不仅能将Fe2+氧化为Fe3+,而且能提高软锰矿的浸出率。写出双氧水提高软锰矿浸出率的离子方程式_____。
(3)制备:在30℃~35℃下, 将碳酸氢铵溶液滴加到硫酸锰净化液中,控制反应液的最终pH在6.5~7.0,得到MnCO3沉淀。温度控制35℃以下的原因是_____;该反应的化学方程式为_____;生成的MnCO3沉淀需经充分洗涤,洗涤的操作方法是_____。
(4)计算:室温下,Ksp(MnCO3)=1.8×10-11,Ksp(MgCO3)=2.6×10-5,已知离子浓度小于1.0×10-5mol·L-1时,表示该离子沉淀完全。若净化液中的c(Mg2+)=10-2mol/L,试计算说明Mg2+的存在是否会影响MnCO3的纯度。___________________
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是某同学设计的放热反应的观察装置。其实验操作步骤如下:
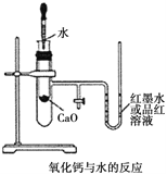
① 按图所示将实验装置连接好;
② 在 U 形管内加入少量红墨水(或品红溶液),打开 T 形管活塞,使 U 形管内两边的液面处于同一水平 面,再关闭 T 形管活塞;
③ 在盛有 1.0g 氧化钙的小试管里滴入 2mL 左右的蒸馏水,观察现象。 试回答:
(1)实验前必须进行的一步实验操作是_____。
(2)实验中观察到的现象是_____。
(3)说明CaO、H2O的能量与Ca(OH)2的能量之间的关系:_________。
(4)若该实验中 CaO 换成 NaCl,实验还能否观察到相同现象?_____(填“能” 或“否”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】
硼和氮的单质及一些化合物在工农业生产等领域有重要应用。回答下列问题:
(1)N原子核外有__________种不同运动状态的电子。基态N原子中,能量最高的电子所占据的原子轨道的电子排布式为:__________
(2)经测定发现N2O5固体由NO2+和NO3-两种离子组成,该固体中N 原子杂化类型分别为__________;与NO2+互为等电子体的微粒有_______________ (写出一种)。
(3)铵盐大多不稳定。NH4F、NH4I中,较易分解的是___________,原因是_____________________
(4)第二周期中,第一电离能介于B元素和N元素间的元素有__________种。
(5)氮化镓是第三代半导体材料,其晶体结构和单晶硅相似,晶胞结构如图所示:
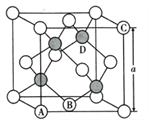
①原子坐标参数是表示晶胞内部各原子的相对位置,其中原子坐标参数A为(0,0,0 );B为(1/2,1/2,0) ;C为(1,0,1)。则D原子的坐标参数为____________________。
②己知氮化镓晶胞的边长为anm,其密度为dg/cm3。则阿伏伽德罗常数NA=__________( 用a、d表示)
查看答案和解析>>
科目: 来源: 题型:
【题目】氮化镓(GaN)被称为第三代半导体材料,其应用已经取得了突破性的进展。
已知:(i)氮化镓性质稳定,不与水、酸反应,只在加热时溶于浓碱。
(ii)NiCl2 溶液在加热时,先转化为Ni(OH)2,后分解为NiO。
(iii)制备氮化镓的反应为:2Ga+2NH3![]() 2GaN+3H2
2GaN+3H2
某学校化学兴趣小组实验室制备氮化镓,设计实验装置如图所示:
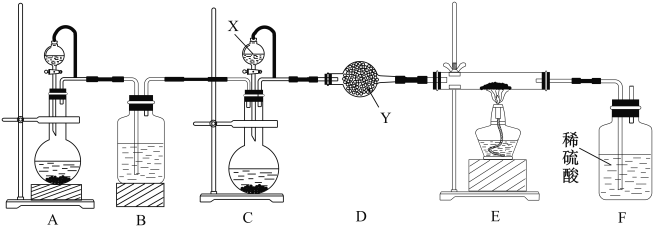
设计实验步骤如下:
①滴加几滴NiCl2 溶液润湿金属镓粉末,置于反应器内。
②先通入一段时间后的H2,再加热。
③停止通氢气,改通入氨气,继续加热一段时间。
④停止加热,继续通入氨气,直至冷却。
⑤将反应器内的固体转移到盛有盐酸的烧杯中,充分反应过滤、洗涤、干燥。
(1)仪器X中的试剂是___________,仪器Y的名称是__________________。
(2)指出该套装置中存在一处明显的错误是________________________。
(3)步骤①中选择NiCl2 溶液,不选择氧化镍的原因是____________________。
a.增大接触面积,加快化学反应速率
b使镍能均匀附着在镓粉的表面,提高催化效率
c.为了能更好形成原电池,加快反应速率
(4)步骤③中制备氮化镓,则判断该反应接近完成时观察到的现象是____________________。
(5)请写出步骤⑤中检验产品氮化镓固体洗涤干净的操作________________________。
(6)镓元素与铝同族,其性质与铝类似,请写出氮化镓溶于热NaOH溶液的离子方程式:______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com