
科目: 来源: 题型:
【题目】某实验兴趣小组按如图装置实验后,所记录内容合理的是
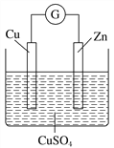
实验记录 | ①Zn片为负极,质量减少,Cu为正极,质量不变; ②外电路电流方向是:由Cu→Zn; ③SO42向Zn极移动,Cu2+向Cu极移动; ④Zn电极发生氧化反应; ⑤正极反应式:Cu2++2e===Cu; ⑥电子流动方向:锌极→导线→铜极→电解质溶液→锌极 |
A. ①②④B. ②③④C. ②③④⑤D. ②③④⑤⑥
查看答案和解析>>
科目: 来源: 题型:
【题目】
有机化合物P具有很好的抑菌活性,其合成路线如下图所示。
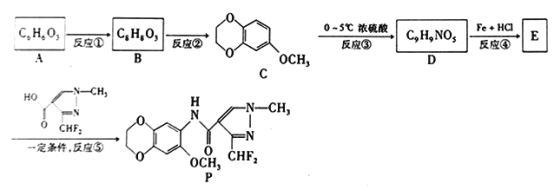
已知: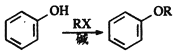 、
、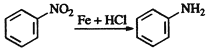
完成下列填空:
(1)化合物B中的含氧官能团为___________,反应⑤的反应类型为__________________。
(2)反应①的试剂和反应条件分别是_____________________________。
(3)E的结构简式为____________,反应③的化学方程式是_____________________________。
(4)反应②和反应③的先后次序不能颠倒,其原因是_____________________________。
(5)写出化合物C满足下列条件的一种同分异构体的结构简式______________。
①含苯环结构,能在碱性条件下发生水解
②能与FeCl3发生显色反应
③分子中含有4种不同化学环境的氢
(6)已知RCN![]() RCOOH
RCOOH
请以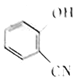 、CH2=CH2为原料合成有机化合物
、CH2=CH2为原料合成有机化合物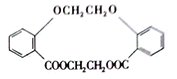 ,写出制备的合成路线流程图(无机试剂任用)。
,写出制备的合成路线流程图(无机试剂任用)。
_____________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】氧化钴(Co2O3)粉体材料在工业、电子、电讯等领域都有着广阔的应用前景。某铜钴矿石主要含有CoO(OH)、CoCO3、Cu2(OH)2CO3和SiO2,其中还含有一定量的Fe2O3、MgO和CaO等。由该矿石制备Co2O3的部分工艺流程如下:
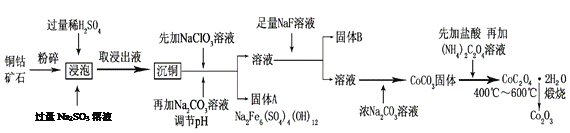
请回答下列问题:
(1)“浸泡”过程中,CoO(OH)可转化为CoSO4,请将该反应的化学方程式补充完整:
2CoO(OH)+2H2SO4+□_______=□CoSO4+□_______+□_______,_____________
(2)固体B的成分是______________________(填化学式)。
(3)向“沉铜”后的滤液中加入NaClO3溶液的主要目的是___________________;若上述流程中固、液分离均采用过滤操作,则共有________________处使用该操作。
(4)根据图1、图2分析:
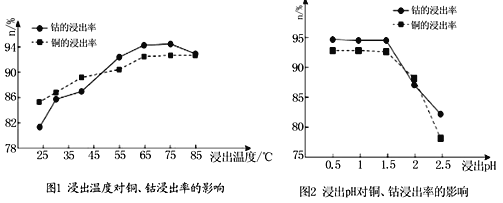
①矿石粉末浸泡的适宜条件应是________________________________。
②图2中铜、钴浸出率下降的可能原因是___________________________________。
(5)CoC2O4·2H2O在空气中高温煅烧得到Co2O3的化学方程式是_____________。
(6)LiCoO2可用于电动汽车的电池,其工作原理如右图所示,且电解质为一种能传导Li+的高分子材料,隔膜只允许Li+通过,电池反应式为:LixC6+Li1-xCoO2 ![]() C6 +LiCoO2
C6 +LiCoO2
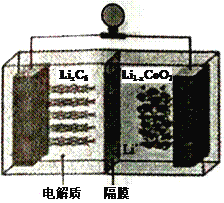
①放电时,Li+移动的方向为_________→___________。(填“ 左”或“ 右”)
②放电时正极的电极反应式为______________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】科学家最近研究出一种环保,安全的储氢方法,其原理可表示为NaHCO3+H2 HCOONa+H2O,下列有关说法不正确的是( )
HCOONa+H2O,下列有关说法不正确的是( )
A. 储氢、释氢过程均有能量变化
B. 储氢过程中,NaHCO3被还原
C. NaHCO3、HCOONa均含有离子键和共价键
D. 释氢过程中,每消耗0.1 mol H2O放出2.24 L的H2
查看答案和解析>>
科目: 来源: 题型:
【题目】在2 L容积不变的容器中,发生N2+3H2 NH3的反应。现通入4 mol H2和4 mol N2,10 s内用H2表示的反应速率为0.12 mol·L-1·s-1,则10 s后容器中N2的物质的量是( )
A. 1.6 mol B. 2.8 mol C. 3.6 mol D. 3.2 mol
查看答案和解析>>
科目: 来源: 题型:
【题目】在温度不变的条件下,在恒容的容器中进行下列反应:N2O4(g)═2NO2(g),若N2O4的浓度由0.1molL﹣1降到0.07molL﹣1需要15s,那么N2O4的浓度由0.07molL﹣1降到0.05molL﹣1所需的反应时间( )
A. 等于5s B. 等于10s C. 小于10s D. 大于10s
查看答案和解析>>
科目: 来源: 题型:
【题目】下图为部分元素在元素周期表中的相对位置。据此回答相关问题:
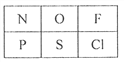
(1)其中非金属性最强的是__________(填元素符号)。
(2)P、S两种元素的最高价氧化物对应的水化物的酸性:H3PO4________H2SO4(填“>”、“<”或“=”)
(3)N位于元素周期表中的第___________族。
(4)F、Cl两种元素氢化物的稳定性:HF_______HCl(填“>”、“<”或“=”)
查看答案和解析>>
科目: 来源: 题型:
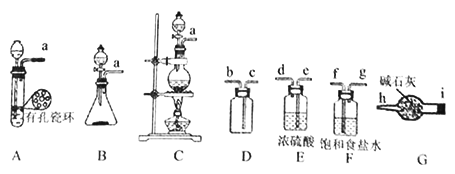
【题目】亚硝酰氯(ClNO)常用于合成洗涤剂、触媒及用作中间体,某学习小组在实验室用Cl2与NO制备ClNO并测定其纯度,进行如下实验(夹持装置略去)。
查阅资料:亚硝酰氯(ClNO)的熔点为-64.5℃、沸点为-5.5℃,气态呈黄色,液态时呈红褐色,遇水易反应生成一种氢化物和两种氮的常见氧化物,其中一种呈红棕色。
请回答下列问题:
Ⅰ.Cl2的制备:舍勒发现氯气的方法至今还是实验室制取氯气的主要方法之一。
(1)该方法可以选择上图中的________(填字母标号)为Cl2发生装置,该反应中被氧化与被还原物质的物质的量之比为_____________。
(2)欲收集一瓶干燥的氯气,选择上图中的装置,其连接顺序为:a→____→i→h(按气流方向填小写字母标号)。
Ⅱ.亚硝酰氯(ClNO)的制备、实验室可用下图装置制备亚硝酰氯(ClNO):
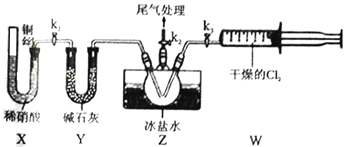
(3)实验室也可用B装置制备NO,与之相比X 装置的优点为__________________________。
(4)组装好实验装置后应先____________,然后依次装入药品、打开k2、再打开__________(填“k1”或“k3”),通入一段时间气体,其目的是为了排尽三颈烧瓶中的空气,防止NO、ClNO 变质。接下来,两种气体在Z中反应的现象为________________________________。
III.亚硝酰氯(ClNO)纯度的测定:将所得亚硝酰氯(ClNO)产品13.10g溶于水,配制成250mL溶液;取出25.00mL,以K2CrO4溶液为指示剂,用0.8mol·L-1AgNO3标准溶液滴定至终点,消耗标准溶液的体积为 22.50mL。(已知:AgCrO4为砖红色固体)
(5)亚硝酰氯(ClNO)与水反应的化学方程式为_________________________。
(6)亚硝酰氯(ClNO)的质量分数为______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com