
科目: 来源: 题型:
【题目】下列有关说法正确的是

A. 水合铜离子的模型如图1所示,1个水合铜离子中含有4个配位键
B. K2O晶体的晶胞如图2所示,每个K2O晶胞平均占有8个O2-
C. 金属Zn中Zn原子堆积模型如图3所示,空间利用率为68%
D. 金属Cu中Cu原子堆积模型如图4所示,为面心立方最密堆积,每个Cu原子的配位数均为8
查看答案和解析>>
科目: 来源: 题型:
【题目】下表中对离子方程式的评价合理的是
选项 | 化学反应及其离子方程式 | 评价 |
A | H2SO4溶液与Ba(OH)2溶液反应: H++ SO42-+Ba2++OH | 正确 |
B | 向碳酸镁浊液中加入足量稀盐酸: CO32-+2H+ | 错误,碳酸镁不应写成离子形式 |
C | 向沸水中滴加饱和的氯化铁溶液至液体变为红褐色:Fe3++3H2O | 正确 |
D | 向NaOH溶液中通入少量CO2反应:OH+CO2 | 正确 |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】资料显示联苯双酯能增强肝脏解毒功能,减轻肝脏的病理损伤,促进肝细胞再生并保护肝细胞,从而改善肝功能。合成联苯双酯的工艺路线如下:
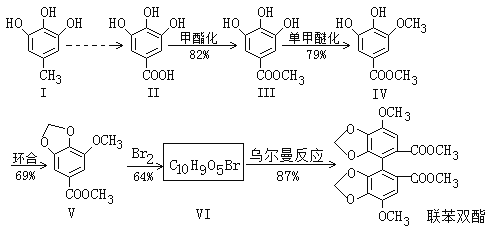
已知:![]()
回答下列问题:
(1)化合物Ⅲ中的官能团名称为______________,该化合物的核磁共振氢谱中有_____组峰。
(2)Ⅴ→Ⅵ的反应类型为______________。写出一定条件下Ⅴ→Ⅵ的化学方程式:____________________。
(3)写出比Ⅴ多2个H原子,且符合下列条件的任意两种同分异构体的结构简式:_________________
①苯环上的一氯代物只有1种;
②能发生银镜反应;
③水解产物之一能与FeCl3溶液发生显色反应;
(4)根据题目中的相关信息并结合已学知识,写出Ⅰ→Ⅱ的合成路线:_________________,该合成路线为何要经过多步而不是一步完成,目的是__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在给定的四种溶液中加入以下各种离子,能在原溶液中大量共存的是
A. 常温下pH=1 的溶液: K+、HCO3-、Br、Ba2+
B. 滴加酚酞溶液显红色的溶液:Fe3+、NH4+、Cl、NO3-
C. 所含溶质为FeCl3的溶液:K+、SO42-、NO3-、H+
D. 强碱性溶液:Cu2+、Na+、Mg2+、NO3-
查看答案和解析>>
科目: 来源: 题型:
【题目】合金在生活、生产、国防等领域有广泛应用。镍是重要的合金元素,例如镧镍合金、白铜(铜镍合金)、铝镍合金等。
(1)基态镍原子的外围电子排布式为_____________。
(2)在NiSO4溶液中滴加稀氨水能形成配位化合物[Ni(NH3)4]SO4。
①H、N、O、Ni的电负性大小顺序为______________________。
②与SO42—互为等电子体的分子(写出一种即可)______________。
③SO32—、SO42—中S的杂化类型都是___________;但它们的实际空间构型却不同,其主要原因是________________________________________________________________。
(3)工业上,采用反应Ni(s)+4CO(g)![]() Ni(CO)4(g)提纯粗镍。推测Ni(CO)4晶体中存在的作用力有__________。
Ni(CO)4(g)提纯粗镍。推测Ni(CO)4晶体中存在的作用力有__________。
a、范德华力 b、配位键 c、非极性键 d、极性键 e、离子键
(4)镧镍合金的晶胞如图1所示,镍原子除了1个在体心外,其余都在面上。该合金中镍原子和镧原子的个数比为________。
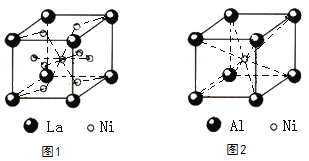
(5)铝镍合金的晶胞如图2所示。已知:铝镍合金的密度为ρg/cm3,NA代表阿伏加德罗常数的数值,则镍、铝的最短核间距(d)为________________pm。
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ、甲醇既是重要的化工原料,又可作为燃料,利用CO和H2在催化剂作用下可合成甲醇(g)。
(1)已知相关的化学键键能数据如下:
化学键 | H—H | C—O | C≡O | H—O | C—H |
E(kJ/mol) | 436 | 343 | 1076 | 465 | 413 |
合成甲醇(g)的热化学方程式为______________________________________________。
(2)500K、101KPa条件下,反应过程中测得n(CO)、n(H2)、n(CH3OH)随时间t变化的关系如图甲所示。现保持其它条件不变,起始只改变温度,在改变的这个温度下反应至t1时刻,此时n(H2)比图象中的值大,那么该温度可能是________。
A、700K B、373K C、以上均不对
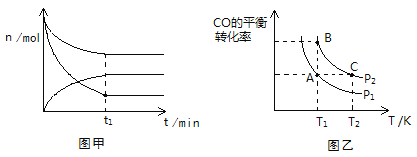
(3)在一容积可变的密闭容器中充入1 mol CO和2 mol H2,发生反应并达到平衡,CO的平衡转化率随温度(T)和压强(P)的变化曲线如图乙所示。P1、P2的大小关系为________;A、B、C三点的平衡常数(K)大小关系为______________________。
Ⅱ、可逆反应:①X(g)+2Y(g)![]() 2Z(g);②2M(g)
2Z(g);②2M(g)![]() N(g)+P(g),分别在密闭容器的两个反应室中进行,反应室之间放有无摩擦、可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示:
N(g)+P(g),分别在密闭容器的两个反应室中进行,反应室之间放有无摩擦、可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示:
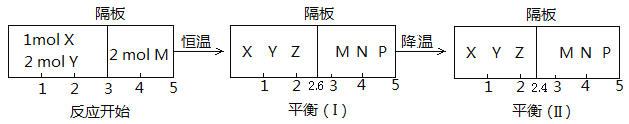
(4)反应①的正反应ΔH______0(填“>”或“<”)。
(5)反应开始时体系的压强与达平衡(Ⅰ)时体系的压强之比为_________(用分数表示)。
(6)在平衡(Ⅰ)和平衡(Ⅱ)中,M的体积分数(Ⅰ)______(Ⅱ)。
A、大于 B、小于 C、等于 D、无法确定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com