
科目: 来源: 题型:
【题目】向AgCl浊液中滴加氨水后可得到澄清溶液,继续滴加浓硝酸后又有沉淀生成。经查资料得知:Ag++ 2NH3·H2O![]() Ag(NH3)2+ 2H2O。下列分析不正确的是
Ag(NH3)2+ 2H2O。下列分析不正确的是
A. 浊液中存在沉淀溶解平衡:AgCl (s)![]() Ag+(aq)+Cl-(aq)
Ag+(aq)+Cl-(aq)
B. 实验可以证明NH3结合Ag+能力比Cl-强
C. 实验表明实验室可用氨水洗涤银镜反应后的试管
D. 由资料信息可推知:加浓硝酸后生成的沉淀为AgCl
查看答案和解析>>
科目: 来源: 题型:
【题目】炒过菜的铁锅未及时洗净(残液中含NaCl),不久便会因被腐蚀而出现红褐色锈斑。腐蚀原理如右图所示,下列说法正确的是

A. 腐蚀过程中,负极是C
B. Fe失去电子经电解质溶液转移给C
C. 正极的电极反应式为4OH―-4e-==2H2O+O2↑
D. 每生成1mol铁锈(Fe2O3·xH2O)理论上消耗标准状况下的O233.6L
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,在3个体积均为1.0 L的恒容密闭容器中反应2H2(g)+CO(g)![]() CH3OH(g) 达到平衡。下列说法正确的是
CH3OH(g) 达到平衡。下列说法正确的是

A. 该反应的正反应放热
B. 达到平衡时,容器Ⅰ中反应物转化率比容器Ⅱ中的大
C. 达到平衡时,容器Ⅱ中c(H2)大于容器Ⅲ中c(H2)的两倍
D. 达到平衡时,容器Ⅲ中的正反应速率比容器Ⅰ中的大
查看答案和解析>>
科目: 来源: 题型:
【题目】某纯碱样品中含有少量氯化钠杂质,现用如图所示装置来测定纯碱样品中碳酸钠的质量分数(铁架台、铁夹等在图中均已略去).实验步骤如下:
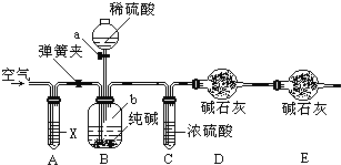
①按图连接装置,并检查气密性;
②准确称得盛有碱石灰(固体氢氧化钠和生石灰的混合物)的干燥管D的质量为85.4g;
③准确称得6g纯碱样品放入容器b中;
④打开分液漏斗a的旋塞,缓缓滴入稀硫酸,至不再产生气泡为止;
⑤打开弹簧夹,往试管A中缓缓鼓入空气数分钟,然后称得干燥管D的总质量为87.6g.试回答:
(1)鼓入空气的目的是___________,装置A中试剂X应选用___________;
(2)若没有C装置,则会导致测定结果___________(填“偏大”或“偏小”);
(3)装置B中发生反应的离子方程式______________________________;
(4)根据实验中测得的有关数据,计算出纯碱样品Na2CO3的质量分数为_________(计算结果保留一位小数)。
查看答案和解析>>
科目: 来源: 题型:
【题目】黄铜灰渣(含有Cu、Zn、CuO、ZnO 及少量的FeO、Fe2O3) 生产氯化铜晶体的流程如下:
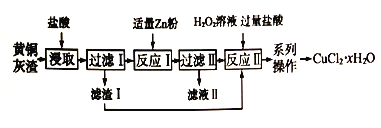
(1)反应I中所加Zn 粉不能过量的原因是_____________。
(2)滤液I中含有的主要金属阳离子是_____________。
(3) 写出反应II 的化学方程式_____________。
(4)“系列操作”包括蒸发浓缩、冷却结晶、过滤、______、_____。
(5) 在空气中直接加热CuCl2·xH2O晶体得不到纯的无水CuCl2,原因是_____________。
(6) 298K 时,向c (Cu2+) =0.02mol/L的溶液中加入氢氧化钠来调节溶液的pH,若反应后溶液pH=10,此时Cu2+是否沉淀完全? _____{列式计算,己知:Ksp[Cu(OH)2] =2.2×10-20,c(Cu2+)<1×10-5mol/L 视为沉淀完全}_____。
(7) CuCl2·xH2O晶体中x值的测定:称取3.420 g 产品溶解于适量水中,向其中加入含AgNO34.400×10-2mol 的AgNO3溶液(溶液中除Cl- 外,不含其他与Ag+反应的离子),待C1-完全沉淀后,用含Fe3+的溶液作指示剂,用0.2000 mol/L 的KSCN 标准溶液滴定剩余的AgNO3。使剩余的Ag+以AgSCN 白色沉淀的形式析出。
①滴定终点的现象是__________。
②若滴定过程用去上述浓度的KSCN 标准溶液20.00mL,则CuCl2·xH2O中x值为_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】据报道,我国研制出“可充电钠——二氧化碳电池”,电极材料为钠金属片和碳纳米管,电解液为高氯酸钠一四甘醇二甲醚,电池总反应为:4Na+3CO2![]() 2Na2CO3+C生成固体Na2CO3沉积在碳纳米管上,下列叙述不正确的是
2Na2CO3+C生成固体Na2CO3沉积在碳纳米管上,下列叙述不正确的是
A. 放电时钠金属片发生氧化反应
B. 放电时每消耗3mo1C02,转移12mol电子
C. 充电时碳纳米管接直流电源的正极
D. 充电时阳极反应为C+2Na2CO3-4e-=4Na++3CO2↑
查看答案和解析>>
科目: 来源: 题型:
【题目】某工厂的工业废水中含有大量的“FeSO4”、较多的Cu2+和少量的Na+。为了减少污染变废为宝,工厂计划从该废水中回收硫酸亚铁和铜。根据流程图,完成回收硫酸亚铁和铜的简单实验方案。回答下列问题:

(1)加入原料①为____________;操作②的名称为___________,该操作所用到的玻璃仪器主要有______。
(2)固体A为____________;
(3)写出加入原料①和②有关反应的离子方程式__________________、________________________。
(4)操作③获得FeSO4·7H2O,需要经过_____、_____、过滤等操作。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于化学反应与能量的说法正确的是
A. 中和反应是吸热反应 B. 燃烧属于放热反应
C. 化学键断裂放出能量 D. 反应物总能量与生成物总能量一定相等
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列说法正确的是
A. 0.5mol/L亚硫酸溶液中含有的H+数日小于NA
B. 12g石墨烯(单层石墨)中含有六元环的个数为1.5NA
C. 1.2g镁在足量的氧气中燃烧,转移的电子数为0.1NA
D. lmolSO2和0.5mo102在VL的密闭容器中充分反应,生成SO3的分子数目为NA
查看答案和解析>>
科目: 来源: 题型:
【题目】为了除去粗盐中Ca2+、Mg2+、SO![]() 及泥沙,可将粗盐溶于水,然后进行下列五项操作。其中正确的操作顺序是( )
及泥沙,可将粗盐溶于水,然后进行下列五项操作。其中正确的操作顺序是( )
①过滤 ②加过量的NaOH溶液 ③加适量盐酸 ④加过量Na2CO3溶液 ⑤加过量BaCl2溶液
A. ②④⑤①③ B. ④②⑤①③ C. ②⑤④①③ D. ⑤②④③①
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com