
科目: 来源: 题型:
【题目】含钴化合物在机械制造、磁性材料等领域具有广泛的应用,请回答下列问题:
(1)基态Co3+的价电子排布图为____。
(2)钴的配合物[Co(NH3)5Br](NO3)2
①第一电离能N_____O(填“大于”、“小于”或“不能确定”);两种配位原子的杂化轨道类型均为____;
②钴离子周围配位键数目(配位数)是 ___;N03-的空间构型为____;
③已知Br的含氧酸酸性由强到弱的顺序为HBrO4>HBrO3>HBrO2>HBrO,其原因是____。
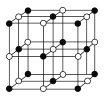
(3)某钴氧化物品体具有CoO2的层状结构如下图所示(小球表示Co,大球表示O)。下列用粗线面出的结构单元不能描述CoO2)的化学组成的是_____

(4)Co的另一种氧化物的晶胞如图,已知钴原子的半径为apm,氧原子的半径为b pm,它们在晶体中是紧密接触的,钴原子填在氧原子的 ___填“正八面体”、“正四面体”或“立方体”)空隙;钴原子与跟它次近邻的氧原子之间的距离为____;在该钴的氧化物品体中原子的空间利用率为____(均用含a、b的计算表达式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】饮用水中的NO3对人类健康会产生危害,为了降低饮用水中NO3的浓度,可以在碱性条件下用铝粉将NO3还原为N2,其化学方程式为:
10Al+6NaNO3+4NaOH=10NaAlO2+3N2↑+2H2O。请回答下列问题:
(1)上述反应中,被氧化的元素_________,还原产物是________。
(2)用“双线桥法”表示反应中电子转移的方向和数目:_______________。
10Al+6NaNO3+4NaOH=10NaAlO2+3N2↑+2H2O
(3)反应中每生成标况下22.4L N2,转移_______mol电子。
(4)请配平下列离子方程式。
____Fe2++____H+ +____NO3=____Fe3+ +____N2O↑+____H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在恒容密闭容器中,将10 mol CO和一定量的H2S混合加热并达到下列平衡:CO(g)+H2S(g) ![]() COS(g)+H2(g) K=1,平衡后CO物质的量为8 mol。下列说法正确的是
COS(g)+H2(g) K=1,平衡后CO物质的量为8 mol。下列说法正确的是
A.CO、H2S的转化率之比为1:1
B.达平衡后H2S的体积分数为4%
C.升高温度,COS浓度减小,表明该反应是吸热反应
D.恒温下向平衡体系中再加入CO、H2S、COS、H2各1 mol,平衡不移动
查看答案和解析>>
科目: 来源: 题型:
【题目】25 ℃时,不同酸性条件下的0.1 mol·L-1 HF溶液中,c(HF)、c(F-)与溶液pH的变化关系如图所示。下列说法正确的是

A. 随着溶液pH增大,![]() 不断增大
不断增大
B. 由水电离出的c(H+):Q>X=Y
C. HF的电离常数Ka=1.0×10-3.2
D. 0.1 mol/LNaF溶液的pH约为8.2
查看答案和解析>>
科目: 来源: 题型:
【题目】25 ℃,两种酸的电离常数如下右表。下列说法正确的是
酸 | Ka1 | Ka2 |
H2SO3 | 1.3×10-2 | 6.3×10-6 |
H2CO3 | 4.2×10-7 | 5.6×10-11 |
A. H2CO3的电离方程式为H2CO3![]() 2H++CO
2H++CO![]()
B. 酸性强弱顺序为H2SO3>H2CO3>HSO>HCO
C. 0.2 mol/L Na2CO3溶液中离子浓度大小顺序为:c(Na+)>c(CO![]() )>c(HCO)>c(OH-)>c(H+)
)>c(HCO)>c(OH-)>c(H+)
D. 足量SO2气体通入NaHCO3溶液中,反应的离子方程式为SO2+HCO==HSO+CO2
查看答案和解析>>
科目: 来源: 题型:
【题目】1-溴丁烷可用作稀有元素萃取剂。实验室制取1-溴丁烷的原理如下:

【产品制备】
如图,在125 mL烧瓶中加入10 mL水,然后加入12 mL(0.22 mol)浓硫酸,摇匀冷却至室温,再加入7.5 mL(0. 08 mol)正丁醇,混合后加入10.3 g(0. 10 mol)溴化钠晶体,充分振荡,加入几粒沸石,在石棉网上用小火加热烧瓶并回流半小时。
(1)仪器a的名称为____,用恰当的化学原理解释能发生反应①的原因是____。
(2)烧杯中所用试剂为水,其主要目的是吸收 ___(填化学式);
(3)制备过程中烧瓶中溶液逐渐出现浅黄色,为此,有人提出用浓H3PO4代替浓H2SO4,其理由是____。
【初步提纯】
已知:醇类可与浓硫酸作用生成![]() 盐溶于浓硫酸中(
盐溶于浓硫酸中(![]() 盐难溶于有机溶剂)。
盐难溶于有机溶剂)。
![]()
步骤①:加热蒸馏出烧瓶中所有的溴丁烷粗品。
步骤②:将粗品用5mL浓硫酸洗涤。
步骤③:将步骤②中有机层依次分别用水、饱和碳酸氢钠溶液和水各10 mL洗涤。
步骤④:将步骤③有机物移入蒸馏烧瓶中,加热蒸馏,得到产品6. 85 g。
(4)步骤①的目的是分离出产品中的无机物,判断溴丁烷是否完全蒸馏出来的方法是:用一支试管收集几滴馏出液,向其中加入少许水并摇动,如果____表明溴丁烷已经被 完全蒸馏出来。
(5)步骤②用5mL浓硫酸洗涤的目的是除去___ ;第一次水洗可以除去大部分硫酸,第二次水洗的目的是____。
(6)实验的产率为____(M(C4H9Br) =137 g/mol);制备过程中,有利于提高产品产率的措施有适当延长回流时间及____(选填字母)。
A.回流时适时搅拌溶液 B.将块状NaBr研细使用
C.将正丁醇分次加入 D.对正丁醇进行干燥处理
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述错误的是
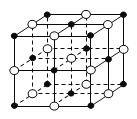
A.含16 g氧原子的二氧化硅晶体中含有的δ键数目为2NA
B.23.4 g NaCl晶体中含有0.1NA个如图所示的结构单元
C.常温常压下,5 g D2O含有的质子数、电子数、中子数均为2.5NA
D.2 mol SO2和1 mol O2在一定条件下反应所得混合气体分子数小于2NA
查看答案和解析>>
科目: 来源: 题型:
【题目】草酸(乙二酸)存在于自然界的植物中,草酸的钠盐和钾盐易溶于水,而其钙盐难溶于水;草酸晶体(H2C2O4·2H2O)无色,熔点为101℃,易溶于水,受热脱水、升华,170℃以上分解。回答下列问题:
(1)甲组同学按照如图所示的装置,通过实验检验草酸晶体的分解产物。装置C中可观察到的现象是________________________,由此可知草酸晶体分解的产物中有_______。

装置B的主要作用是_________________________________________________________。
(2)乙组同学认为草酸晶体分解的产物中含有CO,为进行验证,选用甲组实验中的装置A、B和下图所示的部分装置进行实验。

①乙组的实验装置中,依次连接的合理顺序为A→B→(_____)→( )→( )→( )→I。装置H反应管中盛有的物质是__________;I中集气瓶收集到的气体主要是_________。
②能证明草酸晶体分解产物中有CO的现象是_______________________________。
(3)丙组同学欲进一步证明产物CO能否与Na2O2反应。从A~J中选用装置进行实验,最简单的装置接口连接顺序是:A→B→(_____)→J(盛Na2O2的干燥管);实验后用J中的固体进行验证的方法是:__________________________________(可另选试剂)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com