
科目: 来源: 题型:
【题目】某化学实验需要450 mL 0.10 mol·L-1 Na2CO3溶液,某同学选用Na2CO3·10H2O晶体进行配制,简要回答下列问题:
(1)该实验应选择__________mL容量瓶。
(2)需称取Na2CO3·10H2O的质量为__________g。
(3)该实验的正确操作顺序是_______________(填字母代号)。
A.用托盘天平称取Na2CO3·10H2O晶体
B.上下颠倒摇匀
C.用胶头滴管加水至刻度线
D.洗涤所用仪器并将洗涤液转移进容量瓶
E.将所称取的晶体溶于蒸馏水并冷却至室温
F.将溶液转入容量瓶
(4)另需配制一定浓度的NaOH溶液,称量时若将NaOH固体置于滤纸上称量,则所配溶液浓度______;若容量瓶中有检漏时残留的少量蒸馏水,会使所配溶液浓度______;NaOH溶解后未经______;立即注入容量瓶至刻度线,会使浓度______;定容时必须使凹液面最低处与刻度线相切,若仰视会使所配溶液浓度______(凡涉及浓度变化填“偏高”、“偏低”或“无影响”)。
(5)向200 mL所配的 0.10 mol·L-1Na2CO3溶液中逐滴加入10 mL 12.25%稀H2SO4(ρ=1.0 g/cm3),理论上能收集到标准状况下的气体__________mL。
查看答案和解析>>
科目: 来源: 题型:
【题目】科学家正在研究温室气体CH4和CO2的转化和利用。请回答下列问题:
(1)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用____________形象化描述。在基态14C原子中,核外存在___________对自旋相反的电子。
(2)CH4和CO2所含的三种元素电负性从小到大的顺序为__________________________。
(3)一定条件下,CH4和CO2都能与H2O形成笼状结构(如下图所示)的水合物晶体,其相关参数见下表。CH4与H2O形成的水合物俗称“可燃冰”。
参数 分子 | 分子直径/nm | 分子与H2O的结合能E/kJ·mol-1 |
CH4 | 0.436 | 16.40 |
CO2 | 0.512 | 29.91 |

①下列关于CH4和CO2的说法正确的是________(填序号)。
a.CO2分子中含有2个σ键和2个π键
b.CH4分子中含有极性共价键,是极性分子
c.因为碳氢键键能小于碳氧键,所以CH4熔点低于CO2
d.CH4和CO2分子中碳原子的杂化类型分别是sp3和sp
②为开采深海海底的“可燃冰”,有科学家提出用CO2置换CH4的设想。已知上图中笼状结构的空腔直径为0. 586 nm,根据上述图表所提供的数据分析,提出该设想的依据是______________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】化学是一门以实验为基础的科学。下列是中学化学中一些常见的实验装置,按要求回答下列问题:
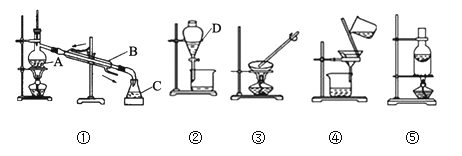
(1)写出仪器名称:D__________。
(2)装置①中的错误是_______________________________。
(3)分离下列混合物的实验操作中,用到实验装置②的是______,用到装置⑤的是________(填字母代号)。
A.水和泥沙的混合物 B.水和酒精的混合物
C.水和四氯化碳的混合物 D.淀粉胶体和氯化钠溶液
E.固体氯化钠和碘单质 F.碳酸钙和碳酸钠粉末
(4)粗盐提纯所需装置为_________和___________,操作过程中均要用到玻璃棒,玻璃棒的作用分别是________________、_________________。
(5)装置②可用于CCl4萃取碘水中的碘,如何检验萃取后的碘水中还存在碘单质_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】硼系高温超导材料都具有良好的应用前景。回答下列问题:
(1)B的基态原子价电子排布式为____________________。BF3的立体构型是_____________________。
H3BO3为一元酸,与足量NaOH溶液反应得到[B(OH)4 ]-,[B(OH)4]-中B的杂化轨道类型为__________________________。
(2)NaBH4被认为是有机化学上的“万能还原剂”,NaBH4的电子式为_________________,其中三种元素的电负性由大到小的顺序是__________________________。
(3)硼与氮形成类似苯的化合物硼氮苯(B3N3H6),俗称无机苯(如图)。硼氮苯属于____________(填“极性”或“非极性”)分子,其间位上的二氯代物有______________种.

(4)NH4BF4 (氟硼酸铵)是合成氮化硼纳米管的原料之一。1mol NH4BF4含有_________mol 配位键。
(5)硼与镁形成的高温超导材料晶体结构如图所示(B在六棱柱柱体内)。该六方晶胞中镁原子与硼原子的数量比为_____________,晶体密度d=_______________g·cm-3

查看答案和解析>>
科目: 来源: 题型:
【题目】下列物质的电离方程式书写正确的是
A. Na2CO3 = Na2+ + CO32
B. NaHCO3 = Na+ + H+ + CO32
C. H2CO3 = 2H+ + CO32
D. Ba(OH)2 = Ba2+ + 2OH
查看答案和解析>>
科目: 来源: 题型:
【题目】皮蛋是人们喜爱的食物,某同学查阅资料得知制作皮蛋的料泥中含有NaOH和Na2CO3,为检验其酸碱性,将料泥溶解过滤后,向滤液中加入
A. 稀硫酸 B. 酚酞试液 C. KNO3溶液 D. NaCl溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】运用化学反应原理研究碳、氮的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义。
(1)乙醇是一种重要的燃料,工业上利用乙烯制酒精:C2H4(g)+H2O(l)=C2H5OH(l) ΔH,已知乙烯、乙醇的燃烧热分别是1411.0kJ·mol-1、1366.8 kJ·mol-1,则ΔH=_____________。
(2)用Cu2Al2O4作催化剂,一定条件下发生反应:CO2(g)+CH4(g)![]() CH3COOH(g),温度与催化剂的催化效率和乙酸的生成速率的关系如图,回答下列问题:
CH3COOH(g),温度与催化剂的催化效率和乙酸的生成速率的关系如图,回答下列问题:

①200~250℃时,乙酸的生成速率升高的主要原因是____________________________。
②300~400℃时,乙酸的生成速率升高的主要原因是____________________________。
(3)甲醇作为一种重要的化工原料。在一定条件下可利用甲醇羰基化法制取甲酸甲酯,其反应原理可表示为CH3OH(g)+CO(g)![]() HCOOCH3(g) ΔH=-29.1kJ/mol。向体积为1L的密闭容器中充入3mol CH3OH(g)和3mol CO(g),测得容器内的压强(p: kPa) 随时间(t: min) 的变化关系如图中Ⅰ、Ⅱ、Ⅲ曲线所示:
HCOOCH3(g) ΔH=-29.1kJ/mol。向体积为1L的密闭容器中充入3mol CH3OH(g)和3mol CO(g),测得容器内的压强(p: kPa) 随时间(t: min) 的变化关系如图中Ⅰ、Ⅱ、Ⅲ曲线所示:

①Ⅱ和Ⅰ相比,Ⅱ中改变的反应条件是_______________________。
②Ⅲ和Ⅰ相比,Ⅲ中改变的反应条件是_________________,判断的理由是________________________。
③反应Ⅰ在5min 时达到平衡,在此条件下从反应开始到达到平衡时v(CH3OH)= ________________。
④反应Ⅱ在2min 时达到平衡,平衡常数K(Ⅱ)= ______________。在体积和温度不变的条件下,在上述反应达到平衡Ⅱ时,再往容器中加入2mol CH3OH 和1mol HCOOCH3后,平衡_______移动(填“正向”“逆向”或“不”),原因是____________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z、W是元素周期表中前36号元素,且原子序数依次增大。其相关信息如下表:
元素编号 | 元素性质或原子结构 |
X | X原子的最外层电子数是其内层电子总数的2倍 |
Y | Y的基态原子价电子排布式为nsnnpn+2 |
Z | 最外层中只有两对成对电子 |
W | 前四周期基态原子中,W元素的未成对电子数最多 |
(1)元素X最高价氧化物分子的空间构型是__________________,是_________(填“极性”或“非极性”)分子。
(2)Y的最简单氢化物的沸点比Z的最简单氢化物的沸点高,原因是____________________________________
(3)基态Z原子中,电子占据的最高电子层符号为_________,该电子层具有的原子轨道数为________________
(4)元素W位于元素周期表的第________族。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)A、B、C三种无色可溶性盐分别是由Na+、Ag+、Ba2+、Cl-、NO![]() 、CO
、CO![]() 中不同的阴、阳离子组成。经实验验证知:A溶液、B溶液均可以与盐酸反应,其中A产生白色沉淀,B产生气泡。则A为_______、B为_________。将B和C的溶液混合后,发生反应的离子方程式为________________。
中不同的阴、阳离子组成。经实验验证知:A溶液、B溶液均可以与盐酸反应,其中A产生白色沉淀,B产生气泡。则A为_______、B为_________。将B和C的溶液混合后,发生反应的离子方程式为________________。
(2)有一包固体粉末,由CaCO3、Na2SO4、KNO3、BaCl2、CuSO4中的三种物质组成,取样品进行如下实验:

从实验可以判断,该固体粉末中一定不含有____________,它的组成可能是__________或_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某工厂为了节能减排,将烟道气中SO2和含Ca(OH)2、NaOH的废碱液作用,经过一系列化学变化,最终得到石膏和过二硫酸钠(Na2S2O8)。设计简要流程如图:

(1)操作a的名称是____________________。废碱液经操作a得到的固体为___________(填化学式)。
(2)向溶液I中通入足量的空气发生反应的化学方程式为_____________________________。
(3)已知用惰性电极电解SO42-可生成S2O82-,其过程如下图所示,S2O82-中S的化合价为__________,阳极生成Na2S2O8的电极反应式为____________________________;在整个流程中可以循环利用的物质是H2O和_________________ (填化学式)。

(4)若制取1mol Na2S2O8且阳极有11.2L的氧气产生(标准状况)。则电解生成的H2在标准状况下的体积为______________L。
(5)烟道气中的SO2可用石灰水吸收,生成亚硫酸钙浊液。常温下,测得某纯CaSO3与水形成的浊液pH为9,已知Ka1 (H2SO3)=1.8×10-2,Ka2 (H2SO3)=6.0×10-9,忽略SO32-的第二步水解,则Ksp(CaSO3)=_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com