
科目: 来源: 题型:
【题目】实验室制备三氯乙醛(CCl3CHO)的反应原理为:C2H5OH+4Cl2→CCl3CHO+5HCl,发生的副反应为:C2H5OH+HCl→C2H5Cl+H2O。某探究小组模拟制备三氯乙醛的实验装置如图所示(夹持、加热装置均略去)。回答下列问题:

(1)装置A中发生反应的离子方程式为________________________________________。
(2)仪器b的名称是__________________,其作用是____________________________。
(3)若撤去装置B,对实验的影响是______________________________________。
(4)实验时发现D中导管口处气泡速率过快,合理的解决方法是______________________。
(5)测定产品的纯度:
①称取0.40g产品,配成待测溶液,加入20.00mL0.100mol/L碘标准溶液,再加入适量碱液,充反应: CCl3CHO +OH-→CHCl3+HCOO-,HCOO-+I2=H++2I-+CO2↑;
②再加适量盐酸调节溶液的pH,并立即用0.020mol/L的Na2S2O3溶液滴定至终点,发生反应: I2+2S2O32-=2I-+S4O62-;
③重复上述操作3次,平均消耗Na2S2O3溶液20.00mL。
滴定时所用指示剂是_____________________,达到滴定终点的现象是_____________,测得产品的纯度为________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】化学与生活密切相关。下列生活中常见物质的俗名与化学式相对应的是( )
A.苛性钠——NaOHB.绿矾——CuSO4·5H2O
C.醋酸——C2H5OHD.熟石灰——CaSO4
查看答案和解析>>
科目: 来源: 题型:
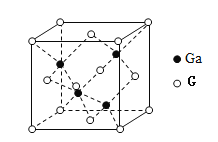
【题目】已知A、B、C、D、E、F、G七种元素的原子序数依次递增,前四种元素为短周期元素![]() 位于元素周期表s区,电子层数与未成对电子数相等;B基态原子中电子占据三种能量不同的原子轨道,且每轨道中的电子总数相同;D原子核外成对电子数为未成对电子数的3倍;F位于第四周期d区,最高能级的原子轨道内只有2个未成对电子;E的一种氧化物具有磁性;C与G同主族。
位于元素周期表s区,电子层数与未成对电子数相等;B基态原子中电子占据三种能量不同的原子轨道,且每轨道中的电子总数相同;D原子核外成对电子数为未成对电子数的3倍;F位于第四周期d区,最高能级的原子轨道内只有2个未成对电子;E的一种氧化物具有磁性;C与G同主族。
(1)![]() 基态原子的价电子轨道排图为______,B2A2的电子式为_______,CD3-的空间构型为______ .
基态原子的价电子轨道排图为______,B2A2的电子式为_______,CD3-的空间构型为______ .
(2)F(BD)n的中心原子价电子数与配体提供电子总数之和为18(1个BD分子可提供的电子数为2),则![]() ______
______ ![]() 根据等电子原理,B、D分子内
根据等电子原理,B、D分子内![]() 键与
键与![]() 键的个数之比为______ .
键的个数之比为______ .
(3)FXO晶体晶胞结构为NaCl型,由于晶体缺陷,x值为![]() ,若晶体中的F分别为F2+、F3+,此晶体中F2+与F3+的最简整数比为______ .
,若晶体中的F分别为F2+、F3+,此晶体中F2+与F3+的最简整数比为______ .
(4)G元素与Ga可形成原子晶体GaG,其晶胞结构如图所示,密度为![]() ,Ga和G的摩尔质量分别为M1g·mol-1和M2g·mol-1原子半径分别为r1pm和r2pm,阿伏伽德罗常数值为
,Ga和G的摩尔质量分别为M1g·mol-1和M2g·mol-1原子半径分别为r1pm和r2pm,阿伏伽德罗常数值为![]() ,则该晶胞中原子的体积占晶胞体积的百分率为______.(写出用M1、和M2、r1、r2、ρ表示的计算式)
,则该晶胞中原子的体积占晶胞体积的百分率为______.(写出用M1、和M2、r1、r2、ρ表示的计算式)
查看答案和解析>>
科目: 来源: 题型:
【题目】有以下反应方程式:
A.CuO+H2![]() Cu+H2O
Cu+H2O
B.2KClO3![]() 2KCl+3O2↑
2KCl+3O2↑
C.Cl2+2NaOH==NaCl+NaClO+H2O
D.2FeBr2+3Cl2=2FeCl3+2Br2
E.MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
F.KClO3+6HCl(浓)=KC1+3H2O+3Cl2↑
G.HgS+O2=Hg+SO2
I.按要求将上述化学方程式序号填入相应空格内:
(1)一种单质使一种化合物中的一种元素被还原____________________;
(2)同一种物质中,同种元素间发生氧化还原反应________________;
(3)所有元素均参加氧化还原反应的是____________________________。
II.已知方程式F:KClO3+6HCI(浓)=KCl+3H2O+3Cl2↑。
(1)请用双线桥法标出电子转移的方向和数目_______________________;
(2)标准状况下当有33.6L的氯气放出时,转移电子的数目是_________________________;
(3)上述反应中氧化产物和还原产物的质量比为____________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)写出下列反应的离子方程式。
①钠和水反应____________________________________。
②硫酸铜溶液中滴加氢氧化钡溶液___________________________________。
(2)3.01×1023个OH-的物质的量为______mol,质量为_______g。
(3)将28g纯净的铁粉投入到200ml足量的稀盐酸中,该反应能够放出标准状况下的气体____L,实验后所得溶液中Fe2+的物质的量浓度为_________mol/L 。
(4)将200 mL 0.5 mol/LNaOH稀释成1000 mL后其物质的量浓度是_________mol/L 。
查看答案和解析>>
科目: 来源: 题型:
【题目】某100 mL无色溶液可能含有Na+、NH4+、Fe3+、CO32-、SO42-、Cl-中的若干种,取该溶液进行连续实验,实验过程如图:(所加试剂均过量,气体全部逸出)
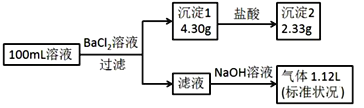
下列说法不正确的是( )
A. 原溶液一定存在CO32-和SO42-,一定不存在Fe3+
B. 若原溶液中不存在Na+,则c(Cl-)<0.1mol·L-1
C. 原溶液中c(Cl-) ≥0.1mol·L-1
D. 原溶液一定存在Cl-,可能存在Na+
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于反应速率的说法中,错误的是( )
A.反应速率用于衡量化学反应的快慢
B.决定反应速率的主要因素是反应物的性质
C.可逆反应达到化学平衡时,正、逆反应速率都为零
D.化学反应中,纯液体物质不能计算其速率
查看答案和解析>>
科目: 来源: 题型:
【题目】金属钛(22Ti)、铁(26Fe)及其相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1)基态Ti原子中,最高能层电子的电子云轮廓形状为_____________,与Ti同周期的所有过渡元素的基态原子中,最外层电子数与钛不同的元素有_________种。
(2)琥珀酸亚铁片是用于缺铁性贫血的预防和治疗的常见药物,临床建议服用维生素C促进“亚铁”的吸收,避免生成Fe3+,从结构角度来看,Fe2+易被氧化成Fe3+的原因是_____________。
(3)SCN-离子可用于Fe3+的检验,其对应的酸有两种,分别为硫氰酸(H-S-C![]() N)和异硫氰酸(H-N=C=S)。
N)和异硫氰酸(H-N=C=S)。
①写出与SCN-互为等电子体的一种微粒______________(分子或离子);
②硫氰酸分子中π键和σ键的个数之比为______________;
③异硫氰酸的沸点比硫氰酸沸点高的原因是__________________________________。
(4)TiCl3可用作烯烃定向聚合的催化剂,如:nCH3CH=CH2![]() 。该反应涉及的物质中碳原子的杂化轨道类型有_______________________;反应涉及的元素中电负性最大的是_____________________________。
。该反应涉及的物质中碳原子的杂化轨道类型有_______________________;反应涉及的元素中电负性最大的是_____________________________。
(5)Ti的某氧化物和CaO相互作用能形成钛酸盐的晶胞结构如图所示(Ti4+位于立方体的顶点,Ca2+处于立方体的中心)。该晶体中,Ti4+和周围________个O2-紧邻;若该晶胞的密度为dg/cm3则钛氧键的键长为________cm(用含NA的代数式表示)。

查看答案和解析>>
科目: 来源: 题型:
【题目】ⅣA族元素及其化合物在材料等方面有重要用途![]() 回答下列问题:
回答下列问题:
(1)碳的一种单质的结构如图![]() 所示
所示![]() 碳原子的杂化轨道类型为______.
碳原子的杂化轨道类型为______.

(2)![]() 分子的立体构型为______,属于______分子
分子的立体构型为______,属于______分子![]() 填“极性”或“非极性”
填“极性”或“非极性”![]() .
.
(3)四卤化硅![]() 的沸点和二卤化铅
的沸点和二卤化铅![]() 的熔点如图
的熔点如图![]() 所示.
所示.
![]() 的沸点依F、Cl、Br、I次序升高的原因是______.
的沸点依F、Cl、Br、I次序升高的原因是______.
![]() 结合
结合![]() 的沸点和
的沸点和![]() 的熔点的变化规律,可推断:依F、Cl、Br、I次序,
的熔点的变化规律,可推断:依F、Cl、Br、I次序,![]() 中的化学键的离子性______填“增强”“不变”或“减弱”
中的化学键的离子性______填“增强”“不变”或“减弱”![]() .
.
(4)碳的另一种单质![]() 可以与钾形成低温超导化合物,晶体结构如图
可以与钾形成低温超导化合物,晶体结构如图![]() 所示
所示![]() 位于立方体的棱上和立方体的内部,此化合物的化学式为______,其晶胞参数为
位于立方体的棱上和立方体的内部,此化合物的化学式为______,其晶胞参数为![]() ,晶体密度为______
,晶体密度为______![]() (列计算式).
(列计算式).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com