
科目: 来源: 题型:
【题目】工业由钛铁矿(主要成分FeTiO3)制备TiCl4的主要工艺流程如下:
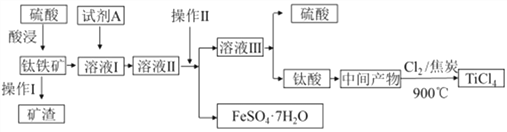
请答下列问题:
(1)已知酸浸反应FeTiO3(s)+2H2SO4(aq)=FeSO4(aq)+TiOSO4(aq)+2H2O,则FeTiO3中钛元素的化合价为_____。
(2)试剂A为____,加入A的目的是____ (填字母)。
A.防止Fe2+被氧化 B.与Fe3+反应 C.防Fe2+水解
“溶液II经“操作II"可得副产品FeSO4·7H2O,则“操作II”包括浓缩、冷却、_____。
(3)若“溶液II中Fe2+的浓度为0.49mol/L,为防止生成Fe(OH)2沉淀,溶液的pH不超过__。(已知Ksp[Fe(OH)2]=4.9×10-17)
(4)钛酸煅烧得中间产物的化学方程式为H2TiO3(s) ![]() TiO2(s)+H2O(g),上述工艺流程中生成TiCl4化学方程式为_____________________。
TiO2(s)+H2O(g),上述工艺流程中生成TiCl4化学方程式为_____________________。
已知TiO2(s)+2Cl2(g)=TiC14(l)+O2(g) △H=+151kJ/mol,该反应极难进行,当向反应体系中加入焦炭后,则反应在高温条件下能顺利发生。从化学平衡的角度解释原因是_______。
(5)TiCl4极易水解,利用此性质可制备纳米级TiO2·xH2O,该反应的化学方程式是_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z三种元素位于周期表中同一周期,其最高价氧化物分别为酸性氧化物、碱性氧化物、两性氧化物,则这三种元素原子序数的大小顺序是( )
A.X>Y>Z
B.X>Z>Y
C.Y>X>Z
D.Y>Z>X
查看答案和解析>>
科目: 来源: 题型:
【题目】海水中蕴藏着丰富的资源,海洋资源的利用具有广阔前景。
Ⅰ.粗盐提纯
(1)从海水中得到的粗盐常含Ca2+、Mg2+、SO42-等杂质,需要提纯后才能综合利用。粗盐提纯的步骤有:①加入过量的Na2CO3溶液;②加入过量的BaCl2溶液;③加入过量的NaOH溶液;④用适量盐酸调节溶液的pH等于7;⑤溶解;⑥过滤;⑦蒸发。
正确的操作顺序是___________________________(填选项字母)。
a.⑤②③①⑥④⑦ b.⑤①②③⑥④⑦ c.⑤②①③④⑥⑦ d.⑤③②①⑥④⑦
(2)判断Mg2+已沉淀完全的方法是:__________________________________________。
II.海带提碘
将海带灼烧成灰,用水浸泡得到海带灰悬浊液,过滤得含I-的海带浸取原液,然后按以下甲、乙两方案提取单质碘:
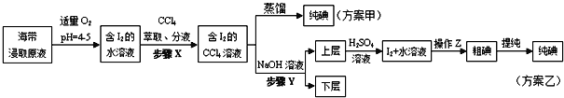
已知:3I2+6OH - ═5I- + IO3-+3H2O;5I-+IO3-+6H+=3I2 +3H2O;酸性条件下,I2在水溶液中的溶解度很小。
(3)分液漏斗使用前须_________;步骤X中,萃取后分液漏斗内观察到的现象是__________。
(4)下列有关步骤Y的说法,正确的是_____________________。
A.应控制NaOH溶液的浓度和体积 B.将碘转化成离子进入水层
C.主要是除浸取原液中的杂质 D.NaOH溶液可由乙醇代替
(5)步骤Y和操作Z的名称分别是___________、 _____________。
(6)方案甲中采用蒸馏不合理,理由是______________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图为某市售盐酸试剂瓶上的部分数据:

(1)该市售盐酸的物质的量浓度为_________mol/L。(计算结果精确到小数点后1位,下同)
(2)欲配制1mol/L盐酸溶液475mL,则需量取该市售盐酸_____mL,除烧杯、量筒、胶头滴管外,还需用到的玻璃仪器是________;下列情况会使所配溶液浓度偏高的是______(填序号)
A.量筒使用前用未干燥
B.用量筒量取浓盐酸时,俯视刻度线
C.量取出的浓盐酸露置较长时间后才加水稀释
D.洗涤量取浓盐酸的量筒,并将洗涤液转移到容量瓶中
(3)浓度均为1mol/L的盐酸与氢氧化钡溶液等体积混合后OH-的物质的量浓度=___________mol/L(忽略溶液体积变化);质量分数分别为36.5%和13.5%的盐酸等体积混合,所得溶液的质量分数__________25%(填“>”“<”或“=”);在标准状况下,1体积水吸收__________体积的HCl气体可制得36.5%的盐酸(水的密度以1.00g/cm3计)。
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D、E五瓶透明溶液,分别是Na2CO3、BaCl2、HCl、NaHSO4、AgNO3中的一种。
①A与D反应有气体生成; ②A与E反应有沉淀生成;
③B与E反应有沉淀生成; ④B与C反应有沉淀生成 ;
⑤C与D反应有气体生成; ⑥在②和③的反应中生成的沉淀是同一种物质
请填空:
(1)在②和③的反应中,生成的沉淀物质的化学式是_______________
(2)D为_________________,E为__________________。
(3)B与D反应的离子方程式为____________________________________。
(4)向一定量的Ba(HCO3)2溶液中,逐滴加入C溶液,直至不再生成沉淀,该过程中发生反应的离子方程式为:________________________________,沉淀完全后,继续滴加C溶液,此时发生反应的化学方程式为:__________________________________。
(5)实验室有一瓶标签破损(如图所示)的固体试剂。某同学取试剂瓶中的固体少量于试管中,加适量蒸馏水溶解,在所得溶液中加入过量BaCl2溶液,得到白色沉淀。由此,该同学推断这瓶试剂是硫酸钠。你认为他的结论是否正确?________。若正确,请写出相应的离子反应方程式;若不正确,请给出
进一步验证的实验方案(要求:所用试剂只能从A、B、C、D、E中选择):__________________________________________________。
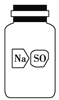
查看答案和解析>>
科目: 来源: 题型:
【题目】碳、氮及其化合物与生活密切相关。请根据要求回答下列问题:
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)= 4NO(g)+CO2(g)+2H2O(g) △H=-574kJ/mol
②CH4(g)+4NO(g)= 2N2(g)+CO2(g)+2H2O(g) △H=-l160kJ/mol
③H2O(g)= H2O(l) △H=-44kJ/mol
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O( 1) 的热化学方程式_________。
(2)已知: 反应I: 4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g) △H < 0
4NO(g)+6H2O(g) △H < 0
反应II: 4NH3(g)+3O2(g) ![]() 2N2(g)+6H2O(g) △H < 0
2N2(g)+6H2O(g) △H < 0
①在恒温恒容装置中充入一定量的NH3 和O2,在催化剂的作用下进行反应I,则下列有关叙述中正确的是___(填字母序号)。
A.增大压强,Kp(用压强表示的化学平衡常数) 增大
B.若测得容器内3v正(NH3)=2v逆(H2O) 时,说明反应已达平衡
C.升高温度,NH3 的转化率增大
D.达到平衡时体系的压强不再变化
②氨催化氧化时会发生上述两个竞争反应I、II。为分析某催化剂对该反应的选择性,在1L密闭容器中充入1molNH3和2molO2,得有关物质的量关系如图,该催化剂在高温时选择反应_____(填“I”或“II”)。
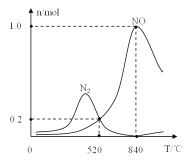
③520℃时,4NH3(g)+3O2 (g)![]() 2N2(g)+6H2O(g)的平衡常数K=_______(只需列出数字计算式)。提高NH3转化为N2平衡转化率的措施有______( 填字母序号)
2N2(g)+6H2O(g)的平衡常数K=_______(只需列出数字计算式)。提高NH3转化为N2平衡转化率的措施有______( 填字母序号)
A.降低反应温度 B.将反应生成的H2O(g)及时移出
C.增大NH3和O2的初始投料比 D.投料比不变,增加反应物的浓度
(3)己知25℃时HCN 和H2CO3的电离常数(Ka.)如下表:
物质 | 电离常数(Ka) |
HCN | Ka=5×10-10 |
H2CO3 | Ka1=4.5×10-7;Ka2=4.7× 10-11 |
25℃时,测得HCN 和NaCN 的混合溶液pH=11,则c(HCN)/c(CN-)=____。向NaCN 溶液中通入少量CO2,则发生反应的离子方程式为:__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】芳香烃A可以合成扁桃酸也可以合成H。以下是合成线路(部分产物、反应条件已略去):
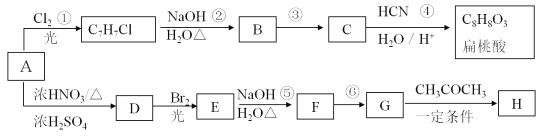
已知:
I.R-CHO+ HCN →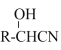
II.R-CN![]() R-COOH
R-COOH
III. 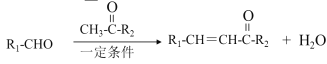
IV.D的相对分子质量为137
请回答下列问题:
(1)扁桃酸中含氧官能团的名称是_______;物质B 的结构简式_______ 。
(2)上述①~⑥反应中属于取代反应的有________ 。
(3)关于H物质,下列说法正确的是______(填字母序号)。
A.所有碳原子可能处于同一平面
B.可以发生加成反应、聚合反应、氧化反应和还原反应
C.H 与G 都能与新制Cu(OH)2反应
(4)写出反应⑥的化学方程式_______________。
(5)X 是扁桃酸的同分异构体,1molX 可与2molNa2CO3 反应,其核磁共振氢谱有四组峰,峰面积之比为3 :2 :2 :1,其结构简式为_________(任写两种)。
(6)请结合所学知识和上述信息,写出由A 和乙醛为原料(无机试剂任用)制备肉桂醛(![]() )的合成路线流程图_______________。
)的合成路线流程图_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,向20mL0.1mol/L氨水中滴加一定浓度的稀盐酸,溶液中水电离的氢离子浓度随加入盐酸体积的变化如右图所示。下列说法错误的是
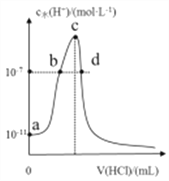
A. 常温下,0.1mol/L氨水的电离平衡常数Kb约为1.0×10-5
B. a、b之间的点一定满足:c(NH4+)>c(Cl-)>c(OH-)>c(H+)
C. c点溶液中c(NH4+)-)
D. c点溶质为NH4Cl
查看答案和解析>>
科目: 来源: 题型:
【题目】现有以下六种物质:①KNO3;②液态HCl;③铜丝;④NaHCO3;⑤Fe(OH)3胶体;⑥CO2
(1)①既是钾盐又是硝酸盐,对该物质的分类方法是___________________________。
(2)既不是电解质也不是非电解质的是(填序号)___________。
(3)实验室制备Fe(OH)3胶体的化学方程式为________________________。将橘红色的硫化锑(Sb2S3)胶体装入U型管,插入电极后通直流电,发现阳极附近橘红色加深,证明Sb2S3胶粒带_____电荷。Fe(OH)3与硫化锑胶体混合,发现体系变浑浊,这是发生了___________。
(4)胃酸中含有盐酸,NaHCO3能治疗胃酸过多,请写出其反应的离子方程式_____________;若患有胃溃疡,此时最好服用含Al(OH)3的胃药,它与胃酸反应的离子方程式为______________;浑浊石灰水中通入过量的CO2,时发生反应的离子方程式是______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com