
科目: 来源: 题型:
【题目】大气中CO2含量的增加会加剧“温室效应”。下列活动会导致大气中CO2含量增加的是( )
A.节约用水用电B.利用风力发电
C.增加植被面积D.燃烧煤炭供热
查看答案和解析>>
科目: 来源: 题型:
【题目】充分燃烧2.8g某有机物A,生成8.8g CO2和3.6g H2O,这种有机物蒸气的相对密度是相同条件下N2的2倍。
(1)求该有机物的分子式。
(2)该有机物链状同分异构体的结构简式为: 。
(3)若在核磁共振氢谱中只有一个信号峰(即只有一种氢原子),则用键线式表示的结构简式为 。
查看答案和解析>>
科目: 来源: 题型:
【题目】化合物H是一种有机光电材料中间体。实验室由芳香化合物A制备H的一种合成路线如下:
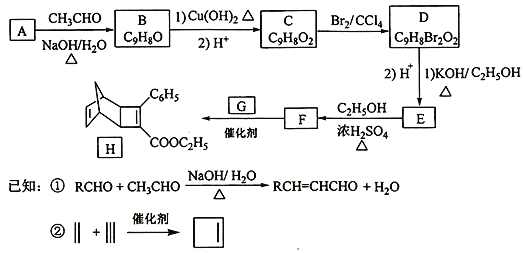
回答下列问题:
(1)A的化学名称为__________。
(2)由C生成D和E生成F的反应类型分别为__________、_________。
(3)E的结构简式为____________。
(4)G为甲苯的同分异构体,由F生成H的化学方程式为___________。
(5)芳香化合物X是F的同分异构体,X能与饱和碳酸氢钠溶液反应放出CO2,其核磁共振氢谱显示有4种不同化学环境的氢,峰面积比为6∶2∶1∶1,写出2种符合要求的X的结构简式____________。
(6)写出用环戊烷和2-丁炔为原料制备化合物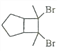 的合成路线________(其他试剂任选)。
的合成路线________(其他试剂任选)。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室可以用高锰酸钾和浓盐酸反应制取氯气,反应的化学方程式如下:
2KMnO4+16HCl(浓)![]() 2KCl+2MnCl2+5Cl2↑+8H2O
2KCl+2MnCl2+5Cl2↑+8H2O
(1)用双线桥法标出电子转移的方向和数目 ________。
(2)该反应中氧化剂与氧化产物物质的量之比是_____。
(3)由该反应判断, KMnO4 的氧化性比 Cl2 的氧化性(选填“强”或“弱”) ________。
(4)如反应中转移了 2mol 电子,则产生的 Cl2 在标准状况下体积为_____L 。
(5)某同学欲用 KMnO4 固体配制100mL 0.5mol/L 的溶液 。回答下列问题:
①配制 KMnO4 溶液时需用的主要仪器有托盘天平、药匙、烧杯、玻璃棒、量筒、_____、_____。
②下列对容量瓶及其使用方法的描述中正确的是(请填序号)_____。
A.容量瓶上标有容积、温度和刻线
B.容量瓶用蒸馏水洗净后,必须加热烘干
C.配制溶液时,把量好的 KMnO4 固体小心放入容量瓶中,加入蒸馏水到接近刻度线 1~2 cm 处,改 用胶头滴管加蒸馏水至刻度线
D.使用前要检查容量瓶是否漏水
③不规范的实验操作会导致实验结果的误差。分析下列操作对实验结果的影响偏小的是_______(请填序 号)
A.加水定容时俯视刻度线 B.容量瓶水洗后有水残留
C.颠倒摇匀后发现凹液面低于刻度线又加水补上 D.在溶解过程中有少量液体溅出烧杯外
查看答案和解析>>
科目: 来源: 题型:
【题目】下列文字表述与反应的离子方程式对应且正确的是 ( )
A. 溴乙烷中滴入AgNO3溶液检验其中的溴元素:Br-+Ag+=AgBr↓
B. 用醋酸除去水垢:CaCO3 + 2H+=Ca2+ + H2O + CO2↑
C. 苯酚与纯碱溶液混合:2C6H5OH + CO32- ![]() CO2 ↑+ H2O + 2C6H5O-
CO2 ↑+ H2O + 2C6H5O-
D. 甲醛溶液与足量的银氨溶液共热:HCHO+4Ag(NH3)2++4OH-![]() CO32-+2NH4++4Ag↓+6NH3+2H2O
CO32-+2NH4++4Ag↓+6NH3+2H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】把纯净的甲烷与氯气的混合气放在集气瓶中,用玻璃片盖好瓶口,放在光亮的地方一段时间后,下列说法中,不正确的是( )
A.气体发生爆炸反应
B.瓶内气体的颜色变浅
C.用一根蘸有浓氨水的玻璃棒伸入瓶内时有白烟产生
D.集气瓶壁有油状液体生成
查看答案和解析>>
科目: 来源: 题型:
【题目】下表为周期表的一部分,其中的编号代表对应的元素,用化学用语回答以下问题。
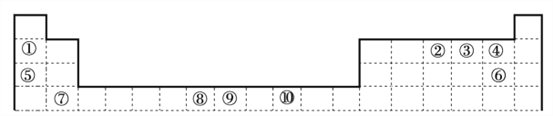
(1)其中属于过渡元素的是_____________,比较②的氢化物与同族第3、4周期元素所形成的氢化物沸点高低并说明理由_____________
(2)②与③中第一电离能较小的元素是_____________;①和④形成的物质与⑤和⑥形成的物质晶体中熔点较高的是_____________。
(3)①形成的有机试剂在有机合成中有重要应用,但极易与O2、CO2等反应。下列说法不正确的是_____________(填字母序号)
a.CO2中键σ与π键的数目之比为1:1
b.游离态和化合态①元素均可由特征发射光谱检出
c.叔丁基锂([(CH3)3C]Li)中碳原子的杂化轨道类型为sp3和sp2
(4)如图一是上述元素形成的物质晶胞结构示意图,其化学式为_____________,其中Fen+的基态电子排布式为_____________,PO43-的空间构型为_____________
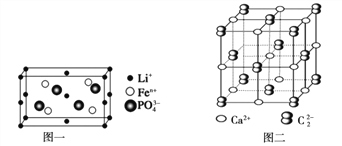
(5)金属①的晶体为体心立方晶胞,其配位数为_____________;若其晶胞边长为a pm,则锂晶体中原子的空间占有率是_____________
(6)上述元素形成的CaC2晶体的晶胞结构与NaCl晶体的相似(如图二所示),但CaC2晶体中哑铃形C22-的存在,使晶胞沿一个方向拉长(粒子间距增加)。CaC2晶体中1个Ca2+周围距离最近的C22-数目为_____________
查看答案和解析>>
科目: 来源: 题型:
【题目】甲醇是重要的化工原料,又可作为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下可合成甲醇。
(1)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(1) △H1=-Q1kJ·mol-1
②2CO(g)+O2(g)=2CO2 (g) △H2=-Q2kJ·mol-1
③H2O(g)=H2O(1) △H3=-Q3kJ·mol-1
请写出甲醇发生不完全燃烧生成一氧化碳和气态水的热化学反应方程式:_____________。
(2)合成甲醇发生的反应如下
①CO(g)+2H2(g) ![]() CH3OH(g) △H1=-a kJ·mol-1
CH3OH(g) △H1=-a kJ·mol-1
②CO2(g)+3H2(g) ![]() CH3OH(g) +H2O(g) △H2=-b kJ·mol-1
CH3OH(g) +H2O(g) △H2=-b kJ·mol-1
③CO2(g)+H2(g) ![]() CO(g)+H2O(g) △H3=+c kJ·mol-1
CO(g)+H2O(g) △H3=+c kJ·mol-1
I:在以上制备甲醇的两个反应中,反应①优于反应②,原因为_____________。
Ⅱ:合成气的组成![]() 时体系中的CO平衡转化率(a)与温度和压强的关系如图所示。
时体系中的CO平衡转化率(a)与温度和压强的关系如图所示。
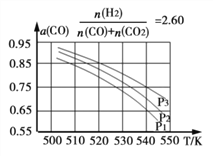
①a(CO)值随温度升高而_____________(填“增大”或“减小”),其原因是_____________
②图中的压强由大到小为_____________,其判断理由是_____________
(3)通常合成甲醇的主要反应为:CO(g)+2H2(g) ![]() CH3OH(g)
CH3OH(g)
①在一定温度下,上述反应在一密闭容器中达到平衡,在保证H2浓度不变的情况下,增大容器的体积,平衡_____________(填字母);作出此判断的理由是_____________。
a.向正反应方向移动 b.向逆反应方向移动 c.不移动
②某温度下,将1 mol CO和4molH2充入2L的密闭容器中,充分反应达到平衡后,测得c(CO)=0.1mol·L-1,则H2的转化率为_____________
查看答案和解析>>
科目: 来源: 题型:
【题目】糖类、油脂和蛋白质是维持人体生命活动所必需的三大营养物质,以下叙述不正确的是
A.蛋白质最终能水解成氨基酸B.淀粉是多糖,可在一定条件下水解
C.油脂属于酯类化合物D.葡萄糖不具有还原性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com