
科目: 来源: 题型:
【题目】锑白(Sb2O3)在工业中有着广泛的作用。用辉锑矿(主要成分为Sb2S3,还含有少量 SiO2)制备锑白的工艺流程如下图:
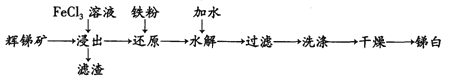
已知:
①Sb3+与Fe2+的氧化性强弱相当。
②Sb2S3不溶于水;Sb2O3为白色粉末,不溶于水,溶于酸和强碱。
③水解时保持溶液的c(H+) =0.1~0.3mol/L。
(1) “浸出”是将辉锑矿溶于FeCl3溶液,为提高浸出速率可采取的措施是_________(任写一种)。请写出其中发生的氧化还原反应离子方程式: _________。滤渣的成分为S单质和_________。
(2) 水解是利用SbCl3的水解反应制取Sb2O3(SbCl3的水解分为多步),其反应可以简单表示为:SbCl3 +3H2O![]() Sb(OH)3 +3HCl,2Sb(OH)3 =Sb2O3 +3H2O。为了促进水解趋于完全,可采取的措施(填两点):_________。
Sb(OH)3 +3HCl,2Sb(OH)3 =Sb2O3 +3H2O。为了促进水解趋于完全,可采取的措施(填两点):_________。
(3) 简述检验沉淀是否洗净的实验方法: _________,若未出现浑浊则证明沉淀己洗干净,反之则没有。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室按照下图所示的操作程序用于提纯某种物质,下列分析一定正确的是

A. 该操作流程可用于分离水与四氯化碳
B. 操作I-定是过滤,目的是将固液分离
C. 可以用于从四氯化碳中提取碘单质
D. 可以提纯含少量BaSO4的NaCI固体混合物
查看答案和解析>>
科目: 来源: 题型:
【题目】亚硝酰氯(ClNO)是有机合成中的重要试剂,工业上可用NO与Cl2合成,回答下列问题:
(1)—定条件下,氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酰氯,涉及热化学方程式和平衡常数如下表:
序号 | 热化学方程式 | 平衡常数 |
① | 2NO2(g) +NaCl(s) | K1 |
② | 4NO2(g) +2NaCl(s) | k2 |
③ | 2NO(g)+Cl2(g) | K3 |
K3=_______(用K1、K2表示)。
(2)25℃时,向体积为2L且带气压计的恒容密闭容器中通入0.08molNO和0.04molCl2发生反应:2NO(g)+Cl2(g) ![]() 2ClNO(g) △H3。
2ClNO(g) △H3。
① 下列描述能说明该反应已达到平衡状态的是_____(填序号)
a.v正(Cl2)=2v逆(NO) b.容器内混合气体的密度保持不变
c.容器内气体压强保持不变 d.容器内混合气体的平均相对分子质量保持不变
②若反应起始和平衡时温度相同,测得反应过程中压强(P)随时间(t)的变化如图I曲线a所示,则△H3______0(填“ >”、“ < ”或“不确定");若其他条件相同,仅改变某一条件时,测得其压强(P)随时间(t)的变化如图I曲线b所示,則改变的条件是_________。
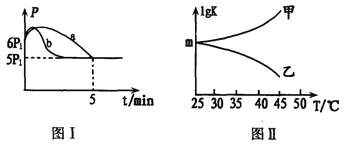
③图II是甲、乙同学描绘上述反应平衡常数的对数值(lgK)与温度的变化关系,其中正确的曲线是____(填“甲”或“乙”);m值为_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】向20mL0.5mol L-1的醋酸溶液中逐滴加入等物质的量浓度的烧碱溶液,测定混合溶液的温度变化如图所示。下列关于混合溶液的相关说法中错误的是
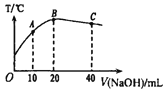
A. 由水电离出的c(H+):C点>B点
B. 醋酸的电离平衡常数:B点> A点
C. 从A点到B点,混合溶液中可能存在:c( CH3COO-) = c(Na+)
D. C 点混合溶液中一定存在:c(Na+) =2c(CH3COO-) +2c(CH3COOH)
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室需要0.2 mol/L NaOH溶液450 mL和0.5 mol/L硫酸溶液500 mL。根据这两种溶液的配制情况回答下列问题:

(l)如图所示的仪器中配制溶液一定不需要的是 ___(填字母序号),配制上述溶液还需用到的玻璃仪器是____填仪器名称)。
(2)在配制NaOH溶液时:
①根据计算,用托盘天平称取NaOH固体____g;
②若NaOH溶液在转移至容量瓶时,洒落了少许,则配置的溶液浓度_____填“偏高”、“偏低”或“无影响”)。
(3)在配制硫酸溶液时:
①所需质量分数为98%、密度为1.84 g/cm3的浓硫酸的体积为____mL(计算结果保留一位小数);
②如果实验室有15 mL、20 mL、50 mL量筒,应选用 ___mL量筒最好。
查看答案和解析>>
科目: 来源: 题型:
【题目】利用I2O5消除CO污染的反应为5CO(g) +I2O5(s) ![]() 5CO2(g) +I2(s),不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入2mol CO,测得CO2的体积分数随时间t变化曲线如图。下列说法正确的是
5CO2(g) +I2(s),不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入2mol CO,测得CO2的体积分数随时间t变化曲线如图。下列说法正确的是
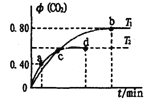
A. 该反应的△H>0
B. T1时CO的平衡转化率为80%
C. 反应处于c点时,一定有v正= v逆
D. d点时,向恒容容器中充入2mol CO,再次平衡后,CO2的体积分数增大
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定温度下,在体积为2L的恒容密闭容器中,某一反应中X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列
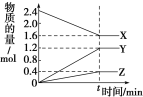
表述中正确的是
A.反应的化学方程式为2X = 3Y + Z
B.t时,正、逆反应都不再继续进行,反应达到化学平衡
C.若t=4,则0~t的X的化学反应速率为0.1 molL-1min-1
D.温度、体积不变,t时刻充入1 mol He使压强增大,正、逆反应速率都增大
查看答案和解析>>
科目: 来源: 题型:
【题目】用压强传感器探究生铁在pH=2和pH=4醋酸溶液中发生腐蚀的装置及得到的图象如下:分析图象,以下结论错误的是

A. 溶液pH≤2时,生铁发生析氢腐蚀
B. 在酸性溶液中生铁可能发生吸氧腐蚀
C. 析氢腐蚀和吸氧腐蚀的速率一样快
D. 两溶液中负极反应均为:Fe﹣2e﹣=Fe2+
查看答案和解析>>
科目: 来源: 题型:
【题目】人剧烈运动时,骨骼肌组织会供氧不足,导致葡萄糖无氧氧化,产生大量酸性物质(分子式为C3H6O3),如果该物质过度堆积于腿部,会引起肌肉酸痛,体现该物质酸性的基团是( )
A.羟基B.甲基C.乙基D.羧基
查看答案和解析>>
科目: 来源: 题型:
【题目】青蒿素是烃的含氧衍生物,为无色针状晶体,易溶于丙酮、氯仿和苯中,在甲醇、乙醇、乙醚、石油醚中可溶解,在水中几乎不溶,熔点为156 --157℃,热稳定性差,青蒿素是高效的抗疟药。已知:乙醚沸点为35℃,从青蒿中提取青蒿素的方法之一是以萃取原理为基础的,主要有乙醚浸取法和汽油浸取法。乙醚浸取法的主要工艺如图所示:

(l)对青蒿干燥破碎后,加入乙醚的目的是_________________。
(2)操作I需要的玻璃仪器主要有烧杯、 ___,操作Ⅱ的名称是___________。
(3)操作Ⅲ的主要过程可能是____(填字母)。
A.加水溶解,蒸发浓缩、冷却结晶
B.加95%的乙醇,浓缩、结晶、过滤
C.加入乙醚进行萃取分液
(4)在用分液漏斗进行分液操作时,为使液体顺利滴下,应进行的具体操作是____,再将分液漏斗下面的活塞拧开,使下层液体慢慢沿 烧杯壁流下。分液后漏斗内剩余的液体从分液漏斗的 ___(填“上口”或 “下口”)倒入烧杯。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com