
科目: 来源: 题型:
【题目】双一(对烷氧基苯甲酸)-2,3一二氯—1,4—苯二酚酯(G)是一种新的液晶化合物,在液晶显示领域里有广泛的应用,其合成路线如下:

已知:R为烷烃基,D的核磁共振氢谱为四组峰,且峰面积之比为9:2:2:1。
回答下列问题:
(1)A的结构简式为______________________________。
(2)B的化学名称为_________________________。
(3)A与B生成C的化学方程式为_____________________________。
(4)由E生成G的反应类型为______________________。
(5)G的分子式为______________________。
(6)H是D的同分异构体,H的苯环上只有两个对位的取代基,H可与FeCl3溶液发生显色反应,且能发生水解反应和银镜反应,则H共有______种;其中核磁共振氢谱为六组峰,且峰面积之比为1:2:6:2:2:1的结构简式为_______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】钾、氟及锌的相关化合物用途非常广泛。回答下列问题:
(1)基态锌原子的价电子排布式为___________;K、F、Zn的电负性从大到小的顺序为___________。
(2)Zn与Ca位于同一周期且最外层电子数相等,钙的熔点与沸点均比锌高,其原因是_______________。
(3)OF2分子的几何构型为___________,中心原子的杂化类型为___________。
(4)KOH 与O3反应可得到KO3(臭氧化钾),KO3 中除σ键外,还存在___________;与O3-互为等电子体的分子为___________ (任 写一种 )。
(5)K、F、Zn组成的一种晶体结构如图所示,其晶胞参数为a=0.4058 nm。

①晶胞中Zn2+的配位数为___________个。
②晶胞中紧邻的两个F-间的距离为_______________________(列出算式即可)nm。
③该晶体的密度为___________(列出算式即可,用NA表示阿伏加德罗常数的数值)g·cm-3。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知丙酮(C3H6O)通常是无色液体,易溶于水,密度小于1g·mL-1,沸点约为55℃。要从水与丙酮的混合物中将丙酮分离出来,下列方法中最为合理的是( )
A.蒸馏B.分液C.过滤D.蒸发
查看答案和解析>>
科目: 来源: 题型:
【题目】镁、硫、氮的化合物在工业上用途非常广泛。
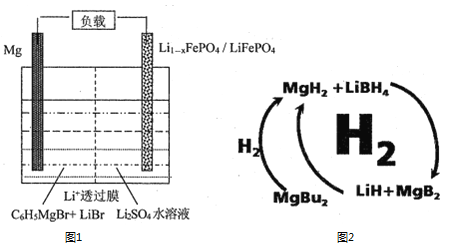
(1)一种镁—锂双离子二次电池的装置如图1所示。
①放电时,Mg电极为_____(填“正极”或“负极”)。
②充电时,Li+迁移至_____________(填“阳极区”或“阴极区”)。
(2)纳米MgH2和LiBH4组成的体系如图2所示,400℃以上受热放氢时发生反应的化学方程式为_____________________________________________。
(3)硝酸厂尾气中含有大量的NO,可用氢气催化还原法除去NO,发生的主要反应如下:
2NO(g)+4H2(g)+O2(g)==N2(g)+4H2O(g) △H =-1143kJ·mol-1
2H2(g)+ O2(g)==2H2O(g) △H =-484kJ·mol-1
则2NO(g)+2H2(g)==N2(g)+2H2O(g) △H =____kJ·mol-1
(4)在一定条件下,反应:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)平衡时CH4的转化率与温度和压强的关系如图3所示。
2CO(g)+2H2(g)平衡时CH4的转化率与温度和压强的关系如图3所示。
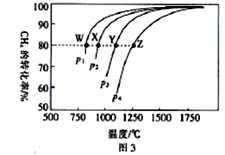
①图中p1、p2、p3、p4代表不同压强,压强最大的是_______。该反应的△H___(填“>”“<”“=”下同)0。
②压强为p4时,在Y点:v(正)__________v(逆)。
③图中W、X、Y、Z四点对应的反应的平衡常数K1、K2、K3、K4由大到小的顺序为______。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列分离方法错误的是( )
A.除去混在植物油中的水——倾倒B.除去粗盐中的泥沙——过滤
C.用乙醚提取中草药中的有效成分——萃取D.除去氯气中的氯化氢气体——洗气
查看答案和解析>>
科目: 来源: 题型:
【题目】PbO(溶于酸,微溶于强碱溶液)在工业上用途广泛,可制作颜料铅白、杀虫剂等。某再生能源企业以含铅废料(主要含Pb、PbO、PbSO4和极少量的PbO2)和稀H2SO4为原料制备高纯PbO的工艺流程如下:

(1)含铅废料中的PbO2和PbSO4中,铅的化合价分别为____________、____________。
(2)酸溶过程中为了加快溶解速率,除了加入FeSO4作催化剂外,还可采取的措施有____________________(任写一种)。
(3)滤液A中含有的主要阳离子是____________________(填离子符号)。
(4)脱硫过程发生的主要反应的离子方程式为________________________________。
(5)冷却、过滤后对所得的固体进行洗涤操作,在实验室洗涤时,所用到的玻璃仪器有烧杯、_________和_________,检验沉淀是否洗涤干净的方法是________________________________。
(6)PbO溶解在NaOH溶液中,存在平衡:PbO(s)+NaOH(aq)![]() NaHPbO2(aq)。PbO的溶解度曲线如图所示。结合该曲线,简述由粗品PbO得到高纯PbO的操作:_______________________________。
NaHPbO2(aq)。PbO的溶解度曲线如图所示。结合该曲线,简述由粗品PbO得到高纯PbO的操作:_______________________________。

查看答案和解析>>
科目: 来源: 题型:
【题目】反应3Fe(s)+4H2O(g)Fe3O4(s)+4H2(g) 在一密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
A.增加Fe(s)的量
B.将容器的体积缩小一半
C.升高温度
D.通入水蒸气
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应既属于氧化还原反应,又是吸热反应的是( )
A.锌粒与稀硫酸的反应
B.水分解生成氢气和氧气
C.甲烷在空气中燃烧的反应
D.Ba(OH)28H2O晶体与NH4Cl晶体的反应
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,向H2CO3溶液中滴入NaOH溶液,溶液中H2CO3、HCO3-及CO32-的物质的量分数δ(X)随溶液pH的变化如图所示{δ(X)=[c(X)/c(H2CO3)+c(HCO3-)+c(CO32-)]×100%}。
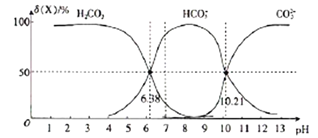
下列说法错误的是
A. H2CO3的一级电离平衡常数的对数值lgK1(H2CO3)=-6.38
B. pH=13时,c(Na+)十c(H+)=c(OH-)+2c(CO32-)
C. 25℃时,反应CO32-+H2O![]() HCO3-+OH-的平衡常数对数值1gK=-3.79
HCO3-+OH-的平衡常数对数值1gK=-3.79
D. pH=7时,c(HCO3-)>c(H2CO3)> c(CO32-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com