
科目: 来源: 题型:
【题目】某同学用下列装置制备并检验Cl2的性质。下列说法错误的是
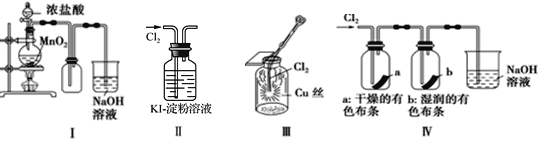
A. Ⅰ图中:如果MnO2过量,浓盐酸就可全部被消耗
B. Ⅱ图中:溶液变蓝
C. Ⅲ图中:生成棕黄色的烟
D. Ⅳ图中:干燥的有色布条不褪色,湿润的有色布条褪色
查看答案和解析>>
科目: 来源: 题型:
【题目】丁苯酞是我国自主研发的一类用于治疗急性缺血性脑卒的新药。合成丁苯酞(J)的一种路线如下:


(1)A的名称是_______________,A分子中最多有_____个原子共平面。
(2)B生成A的化学方程式______________________。
(3)D生成E的反应类型为_________,试剂a是_________。
(4)F的结构简式_____________________。
(5)J是一种酯,分子中除苯环外还含有一个五元环。写出H生成J的化学方程式_____(注明反应条件)。
(6)![]() ,X的同分异构体中:①能发生银镜反应;②能与氯化铁溶液发生显色反应。满足上述条件的X的同分异构体共有______种,写出其中核磁共振氢谱有五组吸收峰的结构简式___________________。
,X的同分异构体中:①能发生银镜反应;②能与氯化铁溶液发生显色反应。满足上述条件的X的同分异构体共有______种,写出其中核磁共振氢谱有五组吸收峰的结构简式___________________。
(7)利用题中信息和所学知识,写出以甲烷和化合物D为原料,合成 ![]() 的路线流程图____________________(其它试剂自选)。
的路线流程图____________________(其它试剂自选)。
查看答案和解析>>
科目: 来源: 题型:
【题目】在日常生产生活中,我们会遇到各种各样的化学反应。下列反应属于氧化还原反应的是
A. 用天然气(主要成分为CH4)逐步代替煤气作为燃料
B. 用无水硫酸铜(CuSO4)检验工业酒精中是否含有少量的水
C. 将生石灰(CaO)投入水中,即可得到建筑用的熟石灰[Ca(OH)2]
D. 碳铵(NH4HCO3)是一种常用的化肥,应保存于阴凉处,因为在较高温度下,它会分解生成氨气、水和二氧化碳
查看答案和解析>>
科目: 来源: 题型:
【题目】如图表示的是A→E五种物质的相互转化关系,其中A为淡黄色固体,B为单质,D为正盐。

请回答下列问题:
(1)写出各物质的名称:
A_____________ ; C_____________;D_____________。
(2)写出相应的离子方程式:
B→C: _____________________________;
C→D: ______________________________;
A→C: _____________________________;
D→E:_____________________________(任写一个即可)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某小组用下图所示装置对Cl2与Na2S2O3溶液的反应进行探究(气密性已检验)。
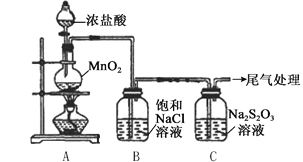
实验操作和现象:
操作 | 现象 |
打开分液漏斗活塞,滴加一定量浓盐酸,加热 | i. A中有黄绿色气体生成,C中液面上方有白雾,溶液中开始出现少量浑浊; ii. 一段时间后,C中产生大量黄色沉淀。 |
用湿润的淀粉碘化钾试纸检验C中白雾 | 淀粉碘化钾试纸变蓝 |
C中浊液过滤后,取少量滤液用盐酸酸化,滴加氯化钡溶液 | 有白色沉淀生成 |
查阅资料:a. S2O32-有较强的还原性
b. 酸性条件下S2O32-迅速分解为S和SO2
(1)A中发生反应的离子方程式是__________。
(2)B中饱和NaCl溶液的作用是_______。
(3)C中生成黄色沉淀的离子方程式是__________。
(4)为检验C中是否有SO2生成,需进行的操作是_______。
(5)C中滤液与氯化钡溶液反应生成白色沉淀,甲同学认为利用该现象可证明Na2S2O3被Cl2氧化,反应的离子方程式是__________。
(6)乙同学认为,C中滤液用硝酸酸化后滴加硝酸银溶液,若有白色沉淀,也能证明Na2S2O3被Cl2氧化,丙同学认为不能证明,理由是__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应中,在原理上可以设计成原电池的是( )
A.Ba(OH)28H2O与NH4Cl的反应
B.铝片与浓硫酸的反应
C.甲烷与氧气的反应
D.石灰石的分解反应
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z、W、E、F、G七种元素为周期表中原子序数依次增大的前四周期元素。6X的一种核素能用于测定文物的年代;Y元素最高价氧化物对应水化物能与其常见氢化物反应生成盐M;Z原子核外成对电子数是未成对电子数的3倍;W的原子半径在同周期主族元素中最大;E的基态原子的所有电子位于四个能级且每个能级均全充满;F的电负性在同周期中最大;G的基态原子N层只有一个电子,内层电子全部排满。请回等下列问题: (用X、Y、Z、W、E、F、G所对应的元素符号表示)
(1)写山F的基态原子的核外电子排布式:______________。
(2)Y、Z、W的电负性由大到小的顺序为_____________。
(3)以下可以表示X的基态原子的原子轨道表示式的是____________。
A. ![]() B.
B. ![]() C.
C. ![]()
(4)下图可以表示F的氢化物中电子云重叠方式的是_______。
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
(5)基态E原子核外存在_____种运动状态不同的电子。
(6)G元素位于周期表中的_____区,基态原子价电子排布式为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】元素周期表是学习化学的重要工具,下图所示为元素周期表中的一部分。表中所列的字母分别代表对应的化学元素。
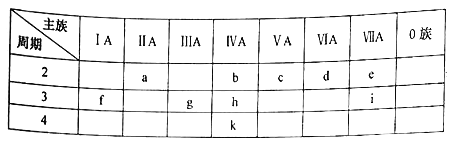
(1)上述元素中,金属性最强的元素在周期表中的位置是______;最高价氧化物对应水化物中酸性最强的元素是___________(填元素符号)。常温下,其单质在浓硝酸中会发生钝化的元素是_______(填元素符号)。
(2)元素g的简单离子结构示意图为______,元素d的一种氢化物中两种原子的个数比为1: 1,则该物质的电子式为___________
(3)k元素可能的性质或应用有________。
A.是一种活泼的金属元素 B.其简单氢化物的热稳定性比h强
C.其单质可作为半导体材料 D.最高正化合价为+4
(4)下列说法正确的是________
A.简单离子半径的大小顺序: r(d>r(e>r(g)>r(f)
B.元素非金属性由强到弱的顺序:e>d>c
C.f、g、i最高价氧化物对应的水化物两两之间能发生反应
D.化合物f2d2中,阴、阳离子个数之比为1:1
(5)元素a与元素g有相似的化学性质。请写出元素a的氢氧化物与NaOH溶液反应的化学方程式:_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】海水是一个巨大的化学资源宝库,利用海水可以获得很多化工产品。
(1)海水中制得的氯化钠可用于生产烧碱及氯气。反应的离子方程式是 。
(2)利用制盐后的盐卤提取溴的工艺流程如下(部分操作和条件已略去):
![]()
将Br2与Na2CO3反应的化学方程式补充完整:
![]()
(3)盐卤蒸发冷却后析出卤块的主要成分是MgCl2,此外还含Fe2+、Fe3+、Mn2+等离子。以卤块为原料制得镁的工艺流程如下(部分操作和条件已略去):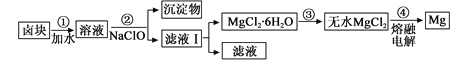
生成氢氧化物沉淀的pH
物质 | 开始沉淀 | 沉淀完全 |
Fe(OH)3 | 2.7 | 3.7 |
Fe(OH)2 | 7.6 | 9.6 |
Mn(OH)2 | 8.3 | 9.8 |
Mg(OH) 2 | 9.6 | 11.1 |
①步骤②中需控制pH=9.8,其目的是 。
②用NaClO 氧化Fe2+得到Fe(OH)3沉淀的离子反应方程式是 。
③步骤③需在HCl保护气中加热进行,请用化学平衡移动原理解释原因________。
④NaClO还能除去盐卤中的CO(NH2)2,生成盐和能参与大气循环的物质。除去0.1mol CO(NH2)2时消耗
NaClO g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com