
科目: 来源: 题型:
【题目】碳、氮及其化合物在工农业生产生活中有着重要作用。请回答下列问题:
(1)汽车尾气中的处理NO的方法也可用H2将NO还原为N2。
已知: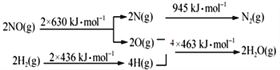
H2还原NO生成氮气和水蒸气的热化学方程是_______________________________。
(2)高炉炼铁产生的高炉气中含有CO、H2、CO2等气体,利用CO和H2在催化剂作用下合成甲醇,是减少污染、节约能源的一种新举措,反应原理为CO(g)+2H2(g)![]() CH3OH(g) ΔH。在体积不同的两个恒容密闭容器中分别充入1molCO和2mol H2,测得平衡混合物中CH3OH 的体积分数在不同压强下随温度的变化如图。
CH3OH(g) ΔH。在体积不同的两个恒容密闭容器中分别充入1molCO和2mol H2,测得平衡混合物中CH3OH 的体积分数在不同压强下随温度的变化如图。
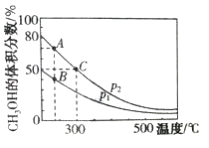
①上述合成甲醇的反应是__________________(填“吸热”或“放热”)反应,图像中的压强p1、p2的大小关系是_______________,判断的理由是________________________。
②从上图A、B、C三点中选填下表物理量对应最大的点(用“A”、“B”或“C”填写)。
反应速率V | 平衡常数K | 平衡转化率a |
____________ | _____________ | _____________ |
③在300℃时,向C点平衡体系中再充入0.25molCO、0.5molH2和0.25molCH3OH。该平衡_________(填“向正反应方向”、“向逆反应方向”或“不”)移动。
(3)有利于提高CO平衡转化率的措施有_________________。
A.使用催化剂 B.投料比不变,增加CO的浓度
C.降低反应温度 D.通入He气体使体系的压强增大
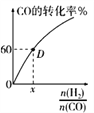
(4)一定温度下,CO的转化率与起始投料比![]() 的变化关系如图所示,测得D点氢气的转化率为40%,则x=__________________。
的变化关系如图所示,测得D点氢气的转化率为40%,则x=__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关电解质溶液的叙述正确的是
A. 室温时,Ka=1×10-5浓度为0.1mol/L 的HA 溶液,pH=3
B. 向0.10mol·L-1NH4HCO3溶液中通CO2至溶液pH=7:c(NH4+)=c(HCO3-)+c(CO32-)
C. 在饱和AgCl、AgBr的混合溶液中加入少量AgNO3溶液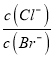 增大
增大
D. 25℃时,向20mL0.01mol/L的醋酸溶液中滴加10mL0.01mol/L的KOH溶液,混合溶液后呈酸性:c(K+) + c(H+)3COOH)+c(OH-)
查看答案和解析>>
科目: 来源: 题型:
【题目】锂一铜空气燃料电池容量高、成本低,具有广阔的发展前景。该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为2Li+Cu2O+H2O=2Cu+2Li++2OH-,下列说法不正确的是
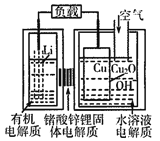
A. 该电池负极不能用水溶液作为电解质
B. 放电时,Li+透过固体电解质向Cu极移动
C. 通空气时铜被腐蚀,表面产生Cu2O
D. 放电时,正极的电极反应式为:O2+2H2O+4e-═4OH-
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A. 环已烷与苯可用酸性KMnO4溶液鉴别
B. 在一定条件下,苯与液溴、硝酸、氢气作用生成溴苯、硝基苯、环己烷的反应都属于取代反应
C. 分子式为C8H10O的某芳香化合物有多种结构,其中含有-CH2OH基团的有4种
D. 异丙苯(![]() )中碳原子可能都处于同一平面
)中碳原子可能都处于同一平面
查看答案和解析>>
科目: 来源: 题型:
【题目】用锌片与稀硫酸反应制取氢气,下列措施不能使氢气的生成速率增大的是( )
A. 加热 B. 将锌片改成锌粉
C. 滴加少量CuSO4溶液 D. 加入适量Na2CO3粉末
查看答案和解析>>
科目: 来源: 题型:
【题目】海水是巨大的资源宝库,海水中氯化物的含量相当高,主要是氯化钠,其次是氯化镁、氯化钙和氯化钾等。从海水中提取食盐和溴的过程如下:
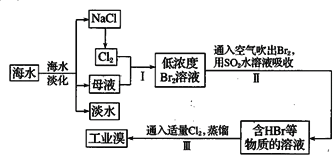
(1)氯原子的结构示意图为____________________。
(2)用NaCl为原料生产氯气的化学方程式为___________________________________。
(3)步骤Ⅱ中用热空气就可以把Br2吹出来的原因是_____________________________。
(4)步骤Ⅱ中用SO2水溶液吸收Br2,可制得HBr和硫酸,试写出该反应的化学方程式_________________________________________________。
(5)步骤Ⅲ用氯气提取溴,这是利用了氯气的__________性。(填“氧化”或“还原”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】氧族元素和卤族元素都能形成多种物质,我们可以利用所学物质结构与性质的相关知识去认识和理解。
(1)下面曲线表示卤族元素某种性质随核电荷数的变化趋势。正确的是_______。

(2)溴化碘(IBr)的化学性质类似于卤素单质,溴化碘和水反应所得产物中有一种为三原子分子,该分子的电子式为_______。
(3)F2与其他卤素单质反应可以生成CF3、BrF3等。已知反应Cl2(g)+3F2(g)=2C1F3(g)△H=-313kJ/mo1;F-F键的键能为159 kJ/mo1;,Cl-C1键的键能为242 kJ/mo1;则ClF3中C1-F键的平均健能为____kJ/mol。ClF3的熔、沸点比BrF3的______(填“高”或“低”)。
(4)根据第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是______。
氟 | 氯 | 溴 | 碘 | |
第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 |
(5)无机含氧酸HmROn可以写成(HO)mROn-m的形式,(n-m)的值越大,HmROn的酸性越强。则酸性:H2SeO4_____H2SeO3(填“<”或“>”)。
(6)S的常见单质S8的结构为![]() ,S原子的轨道杂化方式是______。
,S原子的轨道杂化方式是______。
(7)一定条件下,CH4和CO2都能与H2O形成笼状结构(如下图所示)的水合物晶体。CH4与H2O形成的水合物俗称“可燃冰”。“可燃冰“中存在的分子间作用力是_______。

查看答案和解析>>
科目: 来源: 题型:
【题目】关于氯水性质的描述中不正确的是
A. 观察氯水的颜色,发现氯水呈黄绿色,说明氯水中存在Cl2
B. 向氯水中滴入碳酸钠溶液,有气体生成,说明氯水中存在H+
C. 向氯水中滴加硝酸银溶液,有白色沉淀生成,说明氯水中存在Cl-
D. 氯水经光照后,颜色逐渐消失并放出气体,导致溶液的酸性减弱
查看答案和解析>>
科目: 来源: 题型:
【题目】铜及其化合物在工业生产及生活中用途非常广泛。回答下列问题:
(1)硫酸铜溶液呈蓝色,是因为其中含有[Cu(H2O)4]2+,该离子的结构简式为______(标出配位键,不考虑空间构型)。向硫酸铜溶液中滴加氨水会生成蓝色沉淀,再滴加氨水至沉淀刚全部溶解时可得到蓝色的[Cu(NH3)4SO4溶液,继续向其中加入乙醇会有蓝色晶体析出,原因是_______。
(2)新制Cu(OH)2悬浊液可将乙醛(CH3CHO)氧化成乙酸,而自身还原成Cu2O。乙酸的沸点高于乙醛的主要原因是____________。
(3)配合物[Cu(CH3CN)4]BF4[四氟硼酸四(乙腈)合铜(I)]是有机合成中常见催化剂。该配合物中与中心Cu形成配位健的原子_________。BF4-的空间构型为_____,与其互为等电子体的分子是_____________。
(4)已知:硫酸铜溶液中滴入氨基乙酸钠(H2NCH2COONa)即可得到配合物A。其结构如图所示。

①1mol氨基乙酸钠(H2NCH2COONa)含有σ键的数目为_______。
②标出配合物A中的配位键________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com