
科目: 来源: 题型:
【题目】乙烷、乙烯、乙炔共同具有的性质是( )
A.都能发生聚合反应生成高分子化合物B.能够使溴水和酸性KMnO4溶液褪色
C.分子中各原子都处在同一平面内D.都难溶于水,且密度比水小
查看答案和解析>>
科目: 来源: 题型:
【题目】分枝酸可用于生化研究.其结构简式如图.下列关于分枝酸的叙述正确的是
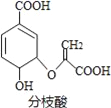
A. 分子中含有2种官能团
B. 可与乙醇、乙酸反应,且反应类型相同
C. 1mol分枝酸最多可与3molNaOH发生中和反应
D. 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
查看答案和解析>>
科目: 来源: 题型:
【题目】绿色化学的核心是反应过程的绿色化,即要求原料物质中的所有原子完全被利用且全部转入期望的产品中,下列过程不符合这一思想的的是
A.甲烷与氯气反应制氯仿:CH4+3Cl2![]() CHCl3+3HCl
CHCl3+3HCl
B.烯烃与水煤气发生的羰基合成反应:RCH=CH2+CO+H2![]() RCH2CH2CHO
RCH2CH2CHO
C.甲烷、CO合成乙酸乙酯:2CH4 + 2CO![]() CH3COOCH2CH3
CH3COOCH2CH3
D.乙烯合成聚乙烯:![]()
![]()
![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关说法正确的是( )
A.第三周期的元素的原子核外都有三个电子层
B.第ⅠA族元素都是典型的金属元素
C.氟、氯、氧、氮四种元素都是第ⅦA族的元素
D.原子的最外层有两个电子的元素都在第ⅡA族
查看答案和解析>>
科目: 来源: 题型:
【题目】由徐光宪院士发起,院士学子同创的《分子共和国》科普读物最近出版了,全书形象生动地戏说了BF3、TiO2、CH3COOH、CO2、NO、二茂铁、NH3、HCN、H2S、O3、异成二烯和萜等众多“分子共和国”中的明星。
(1)写出Fe2+的核外电子排布式__________。
(2)下列说法正确的是_______。
a.H2S和O3分子的构型相同
b.BF3和NH3分子的极性相同
c.CO2、HCN分子中C原子的杂化方式相同
d.CH3COOH分子中C原子的杂化方式相同
(3)N3-与CO2分子互为等电子体,则N3-的空间构型为_______。含Co3+的配合物Co[(N3)(NH3)5]SO4中的配体是_________。
(4)二茂铁是由C5H5-和Fe2+形成的配合物,其结构如图所示。该配合物中共含有____种化学环境不同的氢。
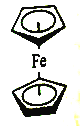
(5)砷和氮位于同一主族,可以形成As2S3、As2O5、H3AsO3、H3AsO4等化合物,它们有着广泛的用途。同答下列问题:
①写出砷的价电子排布式___________。
②工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫。写出该反应的化学方程式: ___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学实验小组设计下图装置制备氯气,图中涉及气体发生、除杂、干燥、收集及尾气处理装置。
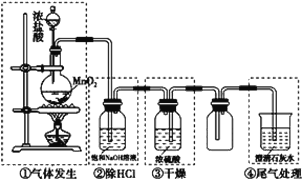
(1)上述装置中,错误的是____________(选填字母)。
A.①②④ B.①②③ C.①③④ D.②③④
(2)写出装置①中发生反应的化学方程式_____________________________________。该反应中,氧化剂是__________________。
(3)使0.15mol MnO2 与过量的12mol/L的浓盐酸反应,使50mL 12mol/L的浓盐酸与足量MnO2反应,两者产生的氯气相比(其他条件相同)____________(选填字母)。
A.一样多 B.前者较后者多
C.后者较前者多 D.无法比较
(4)将新制氯水滴到pH试纸上,有何现象?_________________________________。
(5)工业上用氯气生产漂白粉的化学反应方程式为______________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】周期表中前四周期的元素A、Z、Q、R、T的原子序数依次增大,且A、Z、Q同周期。A共有两个原子轨道上有电子,且电子数目相同。Z、Q相邻,且Z中的未成对电子数为3个,R元素在地壳中含量位于金属元素的第二位。T是人类最早使用的元素,并以这种元素命名了我国的一个时代。请回答下面的问题:
(1)A、Z、Q第一电离能从小到大的顺序为:_______________(填元素符号),T的价层电子排布图为:__________________________。
(2)Q的基态原子中能量最高的电子,其电子云在空间有___________个方向,原子轨道呈_______形。
(3)Z3-的立体构型为____________,写出与Z3-互为等电子体的一种非极性分子化学式____________。
(4)在不同的温度下,A以ACl2和二聚体A2Cl4两种形式存在,二聚体的结构式如图所示:
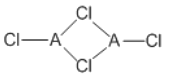
①ACl2中A的杂化方式为______________________。
②1mol A2Cl4中含配位键的数目为____________。
(5)R单质的晶体在不同温度下有两种堆积方式,晶胞分别如图所示。体心立方晶胞和面心立方晶胞的棱边长分别为acm、bcm,则R单质的体心立方晶胞和面心立方晶胞的密度之比为_________,R原子配位数之比为_____________。
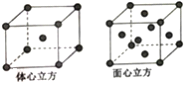
查看答案和解析>>
科目: 来源: 题型:
【题目】从理论上分析,关于Fe﹣CuSO4溶液﹣Cu原电池的叙述正确的是( )
A.铜极为负极
B.电子从铜沿导线转移到铁
C.铁表面析出金属铜
D.总反应为Fe+CuSO4=FeSO4+Cu
查看答案和解析>>
科目: 来源: 题型:
【题目】磁性材料氮化铁镍合金可用Fe(NO3)3、Ni(NO3)2、丁二酮肟(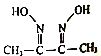 )氨气、氮气、氢氧化钠、盐酸等物质在一定条件下反应制得。
)氨气、氮气、氢氧化钠、盐酸等物质在一定条件下反应制得。
(1)写出基态Ni2+的核外电子排布式:___________。
(2)丁二酮肟分子中四种元素电负性由大到小的顺序为_______,该分子中π键和δ键的个数比为______,其中N原子的轨道杂化方式为________。
(3)过量NH3与F2在铜催化作用下反应生成NF3分子。NF3分子的VSEPR模型为_______。
(4)向Ni(NO3)2溶液中滴加氨水,刚开始时生成绿色Ni(OH)2沉淀,当氨水过量时,沉淀会溶解,生成[Ni(NH3)6]2+的蓝色溶液,写出此沉淀溶解的离子方程式: ____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com