
科目: 来源: 题型:
【题目】由氮的化合物引起的环境污染称为氮污染。
(1)己知CO将NO转化为N2的方程式为2CO(g)+2NO(g)![]() N2(g)+2CO2(g) ΔH,某研究小组在实验中研究温度对NO转化率的影响并绘制图像。
N2(g)+2CO2(g) ΔH,某研究小组在实验中研究温度对NO转化率的影响并绘制图像。
①当n(NO)/n(CO)=l,容器容积恒定时,在不同温度下反应相同的时间测得NO的转化率变化如图所示,则在此反应时间内应控制反应的最佳温度在______左右,该反应的ΔH_____0 (填>或<)。

②该反应的平衡常数表达式为K=__________。
要同时提高平衡常数的值和NO的平衡转化率,可采取的措施是________。
A.降低温度 B.及时将CO2和N2从反应体系中移走
C.升高温度 D.增大压强
③在恒温恒容容器中按体积比2∶1充入CO和NO的混合气体,下列选项能说明正反应速率大于逆反应速率的是_____________(填序号)。
A.CO的浓度保持恒定 B.混合气体的平均相对分子质量逐渐减小
C.CO和NO的物质的量之比逐渐增大 D.CO、NO、N2的速率之比为2∶2∶1
(2)在催化剂存在的条件下,用H2可以将NO还原为N2,己知:

则氢气和一氧化氮反应生成氮气和水蒸气的热化学方程式是_________________。
(3)MAP沉淀法是一种比较新颖有效的处理氨氮废水的方法,.原理如下:向含NH4+的废水中投加磷酸盐和镁盐,使之和NH4+生成难溶复盐MgNH4PO4·6H2O (简称MAP)。MAP沉淀法需要控制反应的PH在7.5-10之间,当PH过高时不利于生成MAP的原因是____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下图是某有机物分子的球棍模型,该有机物中含C、H、O、N四种元素。下列关于该有机物的说法中错误的是
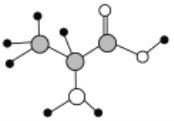
A. 分子式为C3H7O2N
B. 该有机物只能与NaOH溶液反应,不能与盐酸反应
C. 能通过聚合反应生成高分子化合物
D. 其同分异构体中有物质既不能与NaOH溶液反应,又不能与盐酸反应
查看答案和解析>>
科目: 来源: 题型:
【题目】5.1镁铝混合物放入足量氢氧化钠溶液中充分反应后,生成气体在标准状况的体积为2.24L。
计算:(请写详细的计算步骤)
(1)混合物中含有镁的质量为多少克____________?
(2)若反应完成后,溶液体积为50mL,则溶液中含铝化合物的物质的量浓度为多少?______
查看答案和解析>>
科目: 来源: 题型:
【题目】化合物A的相对分子质量为136,分子式为C8H8O2。A分子中只含一个苯环且苯环上只有一个取代基,其红外光谱和核磁共振氢谱如下图。下列关于A的说法中不正确的是


A. A分子属于酯类化合物,在一定条件下能发生水解反应
B. A在一定条件下可与3 mol H2发生加成反应
C. 与A属于同类化合物的同分异构体只有4种
D. 符合题干特征的A分子结构只有1种
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)请将下列5种物质:N2O、FeSO4、Fe(NO3)3、HNO3和Fe2(SO4)3分别填入下面对应的横线上,组成一个化学方程式并配平。
________+________===________+________+________+________H2O
(2)反应物中发生氧化反应的物质为________,被还原的元素是________。
(3)反应中1 mol氧化剂得到________mol电子。
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学课外小组用如图一装置制取溴苯。先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A (A下端活塞关闭)中。
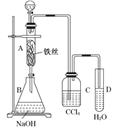
(1)写出A中反应的化学方程式________________。
(2)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是________________,写出有关的化学方程式___________________。
(3)C中盛放CCl4的作用是____________________。
(4)若证明苯和液溴发生的是取代反应,而不是加成反应,可向试管D中加入___________,现象是_______________________ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】某学习小组欲从工业废钒催化剂中回收V2O5,通过分析知该废钒催化剂的主要成分如下表:
物质 | V2O5 | V2O4 | K2SO4 | SiO2 | Fe2O3 | Al2O3 |
质量分数/% | 2.2~29 | 2.8~3.1 | 22~28 | 60~65 | 1~2 | <1 |
他们通过查阅资料找到一种废钒催化剂的回收工艺流程路线如下:
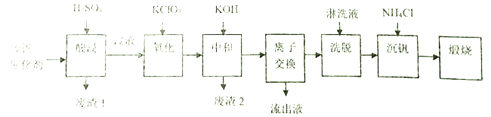
回答下列问题:
(1)“酸浸”时V2O5转化为VO2+,V2O4转成VO2+。则“废渣1”的主要成分是_____________。
(2)“氧化”的目的是使VO2+变为VO2+,写出该反应的离子方程式________________________。
(3)“中和”作用之一是使钒以V4O124-形式存在于溶液中,则“废渣2”的成分有__________(用化学式表示)。
(4)“离子交换”和“洗脱”可简单表示为:4ROH+ V4O124- ![]() R4V4O12+4OH-(ROH为強碱性阴离子交换树脂)。“流出液”中阳离子最多的是_______________;为了提高洗脱效率,淋洗液应该呈______性(填“酸”、“碱“或“中”)。
R4V4O12+4OH-(ROH为強碱性阴离子交换树脂)。“流出液”中阳离子最多的是_______________;为了提高洗脱效率,淋洗液应该呈______性(填“酸”、“碱“或“中”)。
(5)“沉钒”得到偏钒酸铵(NH4VO3)沉淀,写出得到沉定的化学方程式__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)配平下列方程式
①___FeCl3 +___KI===____FeCl2+____KCl+_____I2
②____ClO-+_____Fe(OH)3+_____OH-===_____Cl-+____FeO![]() +____H2O
+____H2O
(2)用浓硫酸配制稀硫酸的过程中,下列操作会使配制的稀硫酸溶液浓度偏高的是___(填序号)。
①量取浓硫酸的量筒用蒸馏水洗涤2~3次,并把洗涤液转入容量瓶
②容量瓶使用时未干燥
③溶解后未经冷却就移液并定容
④定容时不小心有少量蒸馏水滴到瓶外
⑤定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下取0.1mol/L的NaA和NaB 两种盐溶液各1L,分别通入0.02mol CO2,发生如下反应:NaA+CO2+H2O![]() HA+NaHCO3、2NaB+CO2+H2O
HA+NaHCO3、2NaB+CO2+H2O![]() 2HB+N2CO3。HA和HB 的1L 溶液分别加水稀释至体积为VL时可能有如图曲线,则下列说法正确的是
2HB+N2CO3。HA和HB 的1L 溶液分别加水稀释至体积为VL时可能有如图曲线,则下列说法正确的是
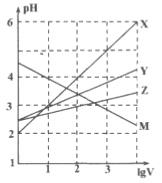
A. X是HA,M是HB
B. 常温下pH: NaA 溶液>NaB 溶液
C. 对于c(R-)/c(HR)·c(OH-)的值(R代表A或B),一定存在HA>HB
D. 若常温下浓度均为0.1mol/L 的NaA和HA 的混合溶液的pH>7,则c(A-)>c(HA)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com