
科目: 来源: 题型:
【题目】过二硫酸钾(K2S2O8) 在科研与工业上有重要用途。
(1)S2O82-的结构式为 ,其中S元素的化合价为_________________。在Ag+催化下,S2O82-能使含Mn2+的溶液变成紫红色,氧化产物是___________(填离子符号)。
,其中S元素的化合价为_________________。在Ag+催化下,S2O82-能使含Mn2+的溶液变成紫红色,氧化产物是___________(填离子符号)。
(2)某厂采用湿法K2S2O8氧化脱硝和氨法脱硫工艺综合处理锅炉烟气,提高了烟气处理效率,处理液还可以用作城市植被绿化的肥料。
①脱硫过程中,当氨吸收液的pH=6时,n(SO32-)∶n(HSO3-) =________。
[巳知:25℃时,Ka1(H2SO3)=1.5×10-2,K a2(H2SO3)=1.0×10-7]
②脱硝过程中依次发生两步反应:第1步,K2S2O8将NO氧化成HNO2,第2步,K2S2O8继续氧化HNO2,第2步反应的化学方程式为______________________________________;
一定条件下,NO去除率随温度变化的关系如右图所示。80℃时,若NO初始浓度为450mg·m-3,t min达到最大去除率,NO去除的平均反应速率:
v(NO) =____mol·L-1·min-1(列代数式)
(3)过二硫酸钾可通过“电解→转化→提纯”方法制得,电解装置示意图如右图所示。

①电解时,铁电极连接电源的_________________极。
②常温下,电解液中含硫微粒的主要存在形式与pH的关系如下图所示。
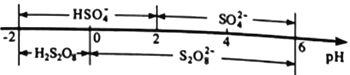
在阳极放电的离子主要是HSO4-,阳极区电解质溶液的pH范围为_________,阳极的电极反应式为________________________。
③往电解产品中加入硫酸钾,使其转化为过二硫酸钾粗产品,提纯粗产品的方法_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下图是中学化学中常用于泡合物的分离和提纯装置,请根据装置回答问题:
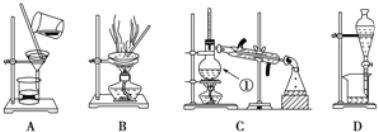
(1)在装置A和装置B中都用到玻璃棒,装置A中玻璃棒的作用是_____,装置B中玻璃棒的作用是_________。
(2)装置C中①的名称是_____,此装置中冷凝水进出方向是_____。装置D中的分液漏斗在使用之前应该_____,在分液时为使液体顺利滴下,应进行的具体操作是_______。
(3)某硝酸钠固体中混有少量硫酸钠杂质,现设计一实验方案,既除去杂质,又配成硝酸钠溶液。
实验方案:先将固体溶于蒸馏水配成溶液,选择合适的试剂和操作完成表格中各步实验。
选择试剂 | ① | Na2CO3溶液 | ④ |
实验操作 | ② | ③ | 加热 |
所加入的试剂①可以是_____(填化学式),证明溶液中SO42-已经除尽的方法是______。加入Na2CO3溶液的目的是_____,所加入的试剂④可以是_____(填化学式)。
(4)青蒿素是高效的抗疟疾药,为无色针状晶体,易溶于丙酮、氯仿和苯中,在甲醇、乙醇、乙醚、石油醚中可溶解,在水中几乎不溶,熔点为156-157℃,热稳定性差。已知:乙醚沸点为35℃。提取青蒿素的主要工艺为:

若要在实验室模拟上述工艺,操作I选择的装置是_____(填代号),操作Ⅱ的名称是_____,选择的装置是_____(填代号),为防止暴沸,粗品中需要加入_____。操作Ⅲ的主要过程可能是_____(填字母)。
A.加水溶解,蒸发浓缩、冷却结晶、过滤
B.加95%的乙醇,浓缩、结晶、过滤
C.加入乙醚进行萃取分液
查看答案和解析>>
科目: 来源: 题型:
【题目】铜板上铁铆钉长期暴露在潮湿的空气中,形成一层酸性水膜后铁铆钉会被腐蚀,示意图如下。下列说法不正确的是

A. 因铁的金属性比铜强,所以铁铆钉被氧化而腐蚀
B. 若水膜中溶解了SO2,则铁铆钉腐蚀的速率变小
C. 铜极上的反应是2H+ + 2e- = H2↑,O2 + 4e-+ 4H+ = 2H2O
D. 在金属表面涂一层油脂,能防止铁铆钉被腐蚀
查看答案和解析>>
科目: 来源: 题型:
【题目】聚合硫酸铁( PFS)是一种高效的无机高分子絮凝剂。某工厂利用经浮选的硫铁矿烧渣(有效成分为Fe2O3和Fe3O4)制备PFS,其工艺流程如下图所示。

(1)“还原焙烧”过程中,CO还原Fe3O4生成FeO的热化学方程式为__ 。
已知:
(2) CO是“还原焙烧”过程的主要还原剂。下图中,曲线表示4个化学反应a、b、c、d达到平衡时气相组成和温度的关系,I、Ⅱ、Ⅲ、Ⅳ分别是Fe2O3. Fe3O4. FeO、Fe稳定存在的区域。a属于____(填
“吸热反应”或“放热反应”);570℃时,d反应的平衡常数K=______。

(3)工业上,“还原焙烧”的温度一般控制在800℃左右,温度不宜过高的理由是____。
(4)若“酸浸”时间过长,浸出液中Fe2+含量反而降低,主要原因是_____ 。
(5)已知![]() 若浸出液中
若浸出液中![]() ,为避免“催化氧化”过程中产生Fe(OH)3,应调节浸出液的pH≤___。
,为避免“催化氧化”过程中产生Fe(OH)3,应调节浸出液的pH≤___。
(6) FeS04溶液在空气中会缓慢氧化生成难溶的Fe(OH)SO4,该反应的离子方程式为____。“催化氧化”过程用NaNO2作催化剂(NO起实质上的催化作用)时,温度与Fe2+转化率的关系如右图所示(反应时间相同),Fe2+转化率随温度的升高先上升后下降的原因是 __。

查看答案和解析>>
科目: 来源: 题型:
【题目】检测明矾样晶(含砷酸盐)中的砷含量是否超标,实验装置如下图所示(夹持装置已略去)。

【实验1】配制砷标准溶液
①取0.132gAg2O3,用NaOH溶液完全溶解后,配制成1LNa3AsO3溶液(此溶液1mL相当于0.10mg砷);
②取一定量上述溶液,配制1L含砷量为1mg·L-1的砷标准溶液。
(1)步骤①中,必须使用的玻璃仪器除烧杯、玻璃棒外,还有__________。步骤②需取用步骤①中Na3AsO3溶液____mL。
【实验2】制备砷标准对照液
①往A瓶中加入2.00mL砷标准溶液,再依次加入一定量的盐酸、KI溶液和SnCl2溶液,混匀,室温放置10 min,使砷元素全部转化为H3AsO3。
②往A瓶中加入足量锌粒(含有ZnS杂质),立即塞上装有乙酸铅棉花的导气管B,并使B管右侧末端插入比色管C中银盐吸收液的液面下,控制反应温度25~40℃,45 min后,生成的砷化氢气体被完全吸收,Ag+被还原为红色胶态银。
③取出C管,向其中添加氯仿至刻度线,混匀,得到砷标准对照液。
(2)乙酸铅棉花的作用是_____________________。
(3)完成生成砷化氢反应的离子方程式:
____Zn+____H3AsO3+____H+=____( )+ ____Zn2++____( )________________
(4)控制A 瓶中反应温度的方法是________________________;反应中,A瓶有较多氢气产生,氢气除了搅拌作用外,还具有的作用是_____________________________。
(5)B管右侧末端导管口径不能过大(约为1mm),原因是__________________________。
【实验3】判断样品中砷含量是否超标
称取ag明矾样品替代【实验2】 ①中“2.00m砷标准溶液”,重复【实验2】后续操作。将实验所得液体与砷标准对照液比对,若所得液体的颜色浅,说明该样品含砷量未超标,反之则超标。
(6)国标规定砷限量为百万分之二(质量分数),则a的值为______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某研究小组以绿矾(FeSO47H2O)为原料制备化合物A[K3Fe(Ⅲ) (C2O4)xyH2O]并通过如下实验步骤确定A的化学式:
步骤1:准确称取A样品4.91g,干燥脱水至恒重,残留物质量为4.37g;
步骤2:将步骤1所得固体溶于水,经测定含Fe3+0.0l00mol;
步骤3:准确称取A样品4.91g置于锥形瓶中,加入足量的3. 00mol-L'1的H2SO4,溶液和适量蒸馏水,用0.500molL-1的KMnO4溶液滴定,当MnO4-恰好完全被还原为 Mn2+时,消耗KMnO4溶液的体积为24.00 mL。
请回答下列问题:
(1)绿矾(FeSO47H2O)若保存不当或长期放置,易与空气中的氧气反应,该反应中 FeSO4表现的性质为_____(填字母)。
A.氧化性 B.还原性 C.氧化性和还原性 D.酸性
(2)用物质的量浓度为18.0 molL-1的浓硫酸配制100mL3.00 molL-1的H2SO4溶液时,量取浓硫酸需要的量筒规格为_____(填字母)。
A.10mL B.25mL C.50mL D.l00mL
(3)步骤2发生的离子反应如下,将该离子方程式配平:_____MnO4-+_____ C2O42-+_____H+=_____Mn2++_____CO2↑+_____H2O。
通过计算确定化合物A中x、y的值(请写出计算过程)。_____________
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)按要求写出方程式:
①HNO3 (电离方程式)_____
②Fe2(SO4)3 (电离方程式)_____
③硫酸钠和氯化钡溶液反应(离子方程式)____
④二氧化碳通入足量氢氧化钠溶液(离子方程式)____________
(2)①0.4molCH4分子中所含原子数与__g HCl分子中所含原子数相等,该HC1气体在标准状况下的体积为________ L;
②等物质的量O2和臭氧(O3),其质量之比为_______;若O2和O3质量相等,则其原子数之比为__。
(3)以下为中学化学中常见的几种物质:①二氧化碳②熔融KC1③NaHSO4固体④铜⑤稀硫酸⑥澄清石灰水,其中属于电解质的有_____,属于非电解质的有____(填编号)。
(4)高铁酸钠(Na2FeO4)(铁为+6价)是一种新型的净水剂,可以通过下述反应制取: 2Fe (OH) 3 + 4NaOH + 3NaC1O = 2Na2FeO4 + 3NaCl + 5H2O
①该反应中氧化剂是_________(用化学式表示,后同),______元素被氧化,还原物为__________ ;
②用单线桥在方程式中标出电子转移的情况:_______________
③当反应中有lmolNaFeO4生成,转移的电子有_________ mol;
④实验室欲配制250mL0.1 molL-1NaOH溶液,除烧杯、玻璃棒、量筒、胶头滴管,还需要用到的玻璃仪器为__________,下列操作配制的溶液浓度偏低的是__________。
A.称量NaOH时,将NaOH放在纸上称重
B.配制前,容量瓶中有少量蒸馏水
C.配制时,NaOH未冷却直接定容
D.向容量瓶中转移溶液时不慎有液滴洒在容量瓶外面
E.定容时俯视刻度线
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是
A. 标准状况下,22.4LCCl4所含分子数为NA
B. 28g CO和N2的混合气体所含的原子数为NA
C. 2mol金属铁与足量的盐酸反应,共失去了 4NA个电子
D. 124g白磷(分子式为P4)所含分子数为4NA
查看答案和解析>>
科目: 来源: 题型:
【题目】㈠下列有关实验的叙述,正确的是(填序号)______________
A、用NaOH溶液除去乙酸乙酯中混有的乙酸、乙醇,然后分液
B、分馏石油时,温度计的末端必须插入液面下
C、用分液漏斗分离环己烷和水的混合液体
D、用浓氨水洗涤做过银镜反应的试管
E、配制银氨溶液时,将稀氨水慢慢滴加到稀硝酸银溶液中,产生白色沉淀后继续滴加到沉淀刚好溶解为止
F、蔗糖水解后,直接滴加新制氢氧化铜悬浊液并加热检验水解产物中的葡萄糖
㈡某化学活动小组设计以下装置进行不同的实验。其中a为用于鼓入空气的气囊,b为螺旋状铜丝,c中盛有冰水。

(1)若用A装置做乙醇与乙酸的酯化反应实验,则还需连接的装置是____(填序号),该装置中应加入试剂__________。从实验安全角度考虑,A装置试管中除加入反应液外,还需加入的固体物质是__________。
(2)该小组同学欲做乙醇氧化成乙醛的实验,则应选用的装置是_________(填序号),再用制得的乙醛溶液进行银镜反应,正确的操作顺序是_____________。
A、②④①③ B、④②③① C、④②①③ D、④①②③
①向试管中滴入3滴乙醛溶液。②一边振荡一边滴入2%的稀氨水,直至最初产生的沉淀恰好溶解为止。③振荡后放入热水中,水浴加热。④在洁净的试管中加入1mL2%的AgNO3溶液。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知A为淡黄色固体,T为生活中使用最广泛的金属单质,D是具有磁性的黑色晶体,C是无色无味的气体,H是白色沉淀。
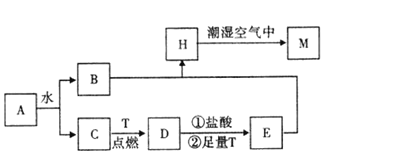
(1)物质A的化学式为 ________。
(2)H在潮湿空气中变成M的实验现象是______________________________________,化学方程式为___________________________________________。
(3)A和水反应生成B和C的离子方程式为___________________________________,由此反应可知A有作为_________的用途。
(4)步骤①的离子方程式_______________________________________,请写出检验步骤①得到的溶液中主要阳离子(除H+外)所需要的试剂:_____________、____________(填化学式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com