
科目: 来源: 题型:
【题目】C1O2是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得C1O2:2KClO3+H2C2O4+H2SO4![]() 2ClO2↑+K2SO4+2CO2↑+2H2O,下列说法中正确的是
2ClO2↑+K2SO4+2CO2↑+2H2O,下列说法中正确的是
A. 在反应中H2C2O4既不是氧化剂也不是还原剂
B. 1 mol KClO3参加反应,在标准状况下能得到22.4 L气体
C. 1 mol KClO3参加反应有2 mol电子转移
D. KClO3在反应中是氧化剂
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,用0.10 mol·L-1HCl溶液滴定20 mL 0.050 mol·L-1Na2CO3和0.025 mol·L-1NaHCO3混合溶液,得出如图所示的滴定曲线。下列说法不正确的是
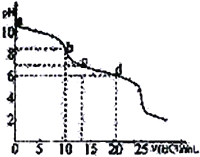
A. a点溶液显碱性的主要原因:CO32-+H2O![]() HCO3-+CH-
HCO3-+CH-
B. b点溶液中:c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)
C. c点溶液中:c(Na+)=c(HCO3-)+2c(CO32-)+ c(Cl-)
D. d点溶液中:c(Na+)> c(Cl-)> c(HCO3-)>c(H+)>c(OH-)
查看答案和解析>>
科目: 来源: 题型:
【题目】室温下,可充电的钠——二氧化碳电池是当今新能源领域的热点,具有优异的性能。下列说法正确的是( )
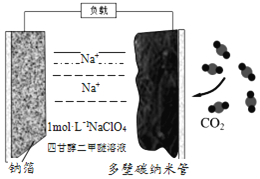
A. 钠金属片为正极
B. 该电池中的电解质为NaClO4,工作时ClO4-向碳纳米管电极移动
C. 总反应为:![]()
D. 放电时,每消耗3molCO2,转移12mol电子
查看答案和解析>>
科目: 来源: 题型:
【题目】I.已知某纯碱试样中含有杂质NaCl,为了确定试样中纯碱的质量分数,可测定其在化学反应中生成CO2的质量,实验装置如下(铁架台及夹持仪器均已省略)。
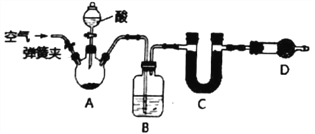
完成下列填空:
(1)B装置中的试剂是_____________,作用是_____________________________。
(2)D装置的作用是___________________________________。
II.测定试样中纯碱质量分数的某次实验步骤如下:①将10.000g纯碱试样放入A中 ②称量C(U型管+碱石灰,下同),质量为l05.160g ③使用分液漏斗滴加足量的酸,使充分反应 ④打开A的弹簧夹,缓缓鼓入一定量的空气 ⑤再次称量C ⑥重复步骤④和⑤,最后得到C的质量为109.l66g。
(3)步骤③中,滴加的酸最好选用________。
a、浓硝酸 b、稀盐酸 c、浓硫酸 d、稀硫酸
当看到____________________现象时即可进行第④步操作。
(4)步骤⑥的目的是_______________________________________________。
(5)由实验数据可知,试样中纯碱的质量分数为_________________(保留3位小数)。
(6)甲同学用上述装置测定某试样中纯碱的质量分数,结果偏高,请帮助他找出造成实验误差的原因。_______________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】捕集CO2的技术对解决全球温室效应意义重大。目前国际空间站处理CO2的一个重要方法是将CO2还原,涉及的化学反应如下:CO2(g)+4H2(g) ![]() CH4(g)+2H2O(g)+Q(Q>0)
CH4(g)+2H2O(g)+Q(Q>0)
完成下列填空:
(1)该反应的平衡常数表达式为________________________________。如果改变某种条件,平衡向正反应方向移动,则平衡常数________(填写编号)。
a、一定增大 b、一定减小 c、可能增大 d、可能减小 e、可能不变
(2)为了提高CO2的捕获百分率,可采取的措施是____________________。(任写一条)
(3)向2L某密闭容器充入1mol CO2和4mol H2,一定条件下发生上述反应。5min末测得气体的物质的量减少了20%,则0~5min内CO2的平均反应速率为_______________。CO2还可应用于纯碱工业。工业生产纯碱的过程中,向饱和的氨化食盐水中通入足量CO2的生产环节又被称为“碳酸化”。
(4)碳酸化时产生的现象是____________________________。碳酸化过程中,溶液中c(CO32-)的变化情况为____________________。
(5)碳酸化后过滤,留在滤液中的阳离子主要有_______________(填写化学式)。简述检验滤液中Cl- 离子的实验操作。________________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】为了除去粗盐中含有的可溶性杂质CaCl2、MgCl2和Na2SO4,需进行下列实验操作,请在()中填写所使用除杂试剂的化学式_____、____、_____、_____、_____,在![]() 中填写实验操作名称_____、_____、_____。
中填写实验操作名称_____、_____、_____。

查看答案和解析>>
科目: 来源: 题型:
【题目】某次实验需用480mL、0.5mol/L 的稀硫酸,某同学用98%的浓硫酸(ρ=1.84g/cm3) 进行配制,请回答下列问题:
(1) 实验需要的玻璃仪器除了烧杯,胶头滴管、量简、玻璃棒,还需要__________;
(2)计算: 需用量筒量取浓硫酸的体积为__________ mL;
(3) 配制过程:
①用量筒量取所需的浓硫酸
②将浓硫酸缓缓注入盛有适量蒸馏水的烧杯中,边加边搅拌,冷却至室温
③用玻璃棒引流将烧杯中的溶液转移到已经检漏的合适规格的容量瓶中
④洗涤烧杯和玻璃棒2~3 次,洗涤液也注入容量瓶中,轻轻摇动容量瓶,使溶液混合均匀
⑤向容量流中加入蒸馏水,在距离刻度1~2cm 时,然后定容
⑥盖好瓶塞,反复上下颠倒,摇匀;
⑦将配制好的溶液转移至试剂瓶中待用。
上述步骤中一定用到胶头滴管的有__________(填序号);
若步骤⑤定容时加水超过刻度线,应该如何处置:___________。
(4) 在横线上填写下列各种情况对所配制溶液浓度的影响(选填“偏高”、“偏低”或“无影响”).
①所用的浓硫酸长时间放置在密封不好的容器中______;
②用量简量取浓硫酸时仰视液面______。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于SO2的叙述,正确的是( )
A.SO2既可以是含硫物质的氧化产物,又可以是含硫物质的还原产物
B.SO2是硫在空气中不完全燃烧的产物,SO3是硫在空气中完全燃烧的产物
C.大气中SO2的主要来源是汽车排出的尾气
D.SO2具有漂白性,因而可以使石蕊试液褪色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com