
科目: 来源: 题型:
【题目】可用图示装置制取少量乙酸乙酯(酒精灯等在图中均已略去)。请填空:

(1)试管a中需要加入浓硫酸、冰醋酸和乙醇各2 mL,正确的加入顺序及操作是______________________。
(2)为防止a中的液体在实验时发生暴沸,在加热前应采取的措施是________。
(3)实验中加热试管a的目的是:①______________;②______________。
(4)试管b中加有饱和Na2CO3溶液,其作用是________________。
(5)反应结束后,振荡试管b,静置。观察到的现象是________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】苄丙酮香豆素(H)常用于防治血觑栓栓塞性疾病。其合成路线如图所示(部分反应条件略去。)
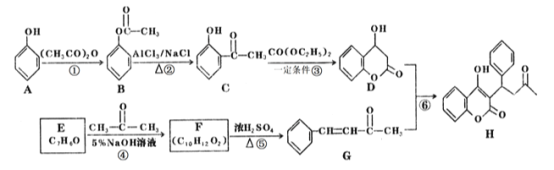
(1)E的名称是_________,D中含氧官能团的名称是_________。
(2)反应①的反应类型是__________,反应⑤的反应类型是_________。
(3)1mol H与H2加成,最多可消耗_____mol H2。
(4)反应③的化学方程式为____________________________________。
(5)C的同分异构体中满足下列条件的有______种,其中核磁共振氢谱有4组峰且峰面积之比为1:2:2:3的结构简式为__________(写一种即可)。
①不能和FeCl3溶液发生显色反应 ②1mol该有机物能与2molNaOH恰好完全反应
(6)参照苄丙酮香豆素的合成路线,设计一种以E和乙醛为原料制备![]() 的合成路线________。
的合成路线________。
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 25℃,1.01105Pa,64gSO2中含有的原子数不是标准状况不能计算
B. 通常状况下,NA 个CO2分子占有的体积为22.4 L
C. 46g二氧化氮(NO2)和46g四氧化二氮(N2O4)含有的原子数不一样多
D. 常温常压下,1.06 g Na2CO3含有的Na+离子数为0.02 NA
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关人类重要的营养物质的说法中,正确的是
A. 油脂属于酯类物质,是一种高分子化合物
B. 淀粉和纤维素及蔗糖等均属于糖类物质
C. 植物体内主要含纤维素,所以植物的生命现象和蛋白质无关
D. 淀粉纤维素油脂和蛋白质是人类的主食,它们均能在人的胃中被分解和消化
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法不正确的是
A.甲烷分子中的所有原子处于同一平面上
B.煤的液化、气化和干馏均属于化学变化
C.乙炔和溴的四氯化碳溶液发生加成反应而使其褪色
D.苯分子中不存在碳碳单键和碳碳双键交替出现的结构
查看答案和解析>>
科目: 来源: 题型:
【题目】已知N、S、Cl元素可形成多种物质,在工业生产上有着广泛的应用。回答下列问题:
(1)Fe3+可与SCN-形成多种配离子,其中一种为[Fe(SCN)6]3-,该配离子中的SCN-会使铁的剩余价电子压缩配对,则每个配离子中铁的单电子个数为_______个。
(2)Se与S是同族元素,请写出基态Se原子电子排布式______。N与S是不同族元素,请解释NH3比H2S在水中溶解度大的原因:__________________。
(3)有一种由1~9号元素中的部分元素组成,且与SCl2互为等电子体的共价化合物,它的分子式为__________。借助等电子体原理可以分析出SCN-中σ键和π键的个数比为__________。
(4)已知S4O62-的结构为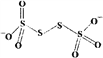 ,其中S原子的杂化方式是______。 N、P可分别形成多种三角锥型分子,已知NH3的键角大于PH3,原因是____________。
,其中S原子的杂化方式是______。 N、P可分别形成多种三角锥型分子,已知NH3的键角大于PH3,原因是____________。
(5)离子晶体中阳离子和阴离子的半径比不同可形成不同的晶胞结构,见下表:
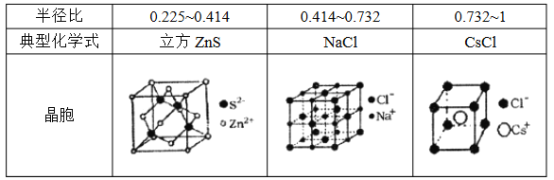
已知某离子晶体RA,其阴阳离子半径分别为184pm和74pm,摩尔质量为Mg/mol,则阳离子配位数为_________,晶体的密度为_________g/cm3(列出计算式,无需化简,设NA为阿伏加德罗常数的值)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A.正丁烷和异丁烷属于同系物
B.乙烯和苯都能与 H2 发生加成反应,说明二者的分子中均含碳碳双键
C.乙醇与金属钠能反应,且在相同条件下比水与金属钠的反应要缓慢
D.乙醛能被还原成乙醇,但不能被氧化成乙酸
查看答案和解析>>
科目: 来源: 题型:
【题目】用双线桥法标出下列反应中电子转移的方向和数目:_____________。
MnO2 + 4HCl(浓) ![]() MnCl2 + Cl2↑+ 2H2O
MnCl2 + Cl2↑+ 2H2O
此反应中,还原剂是 _______,氧化剂是 ________;_____元素被氧化,__元素被还原。由此可知,氧化还原反应的实质是__________________________________________。根据你的理解再写一个常见的氧化还原反应的化学方程式: _______________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com