
科目: 来源: 题型:
【题目】金属钛被称为“21世纪金属”。工业上由钛铁矿(主要成分FeTiO3)制备TiCl4的主要工艺流程如下:
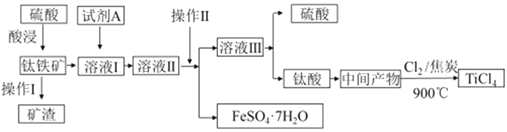
回答下列问题:
(1)已知酸浸反应FeTiO3(s)+2H2SO4(aq)=FeSO4(aq)+TiOSO4(aq)+2H2O,则FeTiO3中铁元素的化合价为_____。加热TiOSO4溶液可制备TiO2·nH2O胶体,其反应的化学方程式为__________。为提高钛铁矿的酸浸出率,可采取的办法除粉碎矿石外,还可以采取的办法有__________、_______(写出两种方法)。
(2)加入A的目的是____(填字母)。
A.防止Fe2+被氧化 B.与Fe3+反应 C.防Fe2+水解
溶液II经操作II可得副产品FeSO4·7H2O,则操作II包括浓缩、冷却、_____、_____。
(3)常温下,若溶液II中Fe2+的浓度为0.49mol/L,为防止生成Fe(OH)2沉淀,溶液的pH不超过_____。(已知Ksp[Fe(OH)2]=4.9×10-17)
(4)钛酸煅烧得中间产物的化学方程式为H2TiO3(s) ![]() TiO2(s)+H2O(g),上述工艺流程中,氯气与焦炭均足量时生成TiCl4的化学方程式为__________________________。
TiO2(s)+H2O(g),上述工艺流程中,氯气与焦炭均足量时生成TiCl4的化学方程式为__________________________。
(5)可利用TiO2通过下述两种方法制备金属钛:
方法一: 通过以下反应制备金属钛
①TiO2 (s)+2Cl2(g) ![]() TiCl4(g)+O2(g) △ H=+151kJ/mol
TiCl4(g)+O2(g) △ H=+151kJ/mol
②TiCl4+2Mg![]() 2MgCl2+Ti
2MgCl2+Ti
方法二:将TiO2作阴极,石墨作阳极,熔融CaO为电解液,碳块作电解槽池,电解TiO2制得钛,阳极上一定生成的气体是___________,可能生成的气体是______________。
从绿色化学角度,你认为上述两种方法中那种更好,并说明理由___________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,取0.1mol/L的NaA和NaB两种盐溶液各1L,分别通入0.02molCO2,发生如下反应:NaA+CO2+H2O=HA+NaHCO3、2NaB+CO2+H2O=2HB+Na2CO3。HA和HB的1L溶液分别加水稀释至体积为VL时可能有如图曲线,则下列说法正确的是
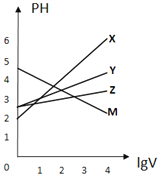
A. 相同条件下,对于c(R-)/[c(HR)·c(OH-)]的值(R代表A或B),一定存在HA>HB
B. 常温下pH:NaA溶液>NaB溶液
C. X是HA,M是HB
D. 若常温下浓度均为0.1mol/L的NaA和HA的溶液等体积混合,则c(A-)+c(HA)=0.2mol/L
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应属于取代反应的是
A.乙醇在铜做催化剂下与氧气反应B.苯在浓硫酸作催化剂下与硝酸反应
C.乙醛在催化剂下与氧气反应D.乙烯使溴的四氯化碳溶液褪色
查看答案和解析>>
科目: 来源: 题型:
【题目】下图是某学校实验室从化学试剂商店买回的磷酸试剂标签上的部分内容,现用该磷酸配制0.2 mol/L的稀磷酸。可供选用的仪器有:

①胶头滴管; ②烧瓶; ③烧杯; ④药匙; ⑤量筒; ⑥托盘天平;⑦玻璃棒; ⑧容量瓶。 请回答下列问题:
(1) 配制稀磷酸时,上述仪器中不需要用到的有__________(选填序号)。
(2)该磷酸的物质的量浓度为________________________________。
(3)若实验室中需要用到475mL0.2mol/L的稀磷酸,则在实际配制过程中实验人员需用量筒量取上述磷酸____________________mL。
(4)下列操作会使所配制的溶液浓度偏低的是__________________。(填序号)
A.量取磷酸时,俯视刻度线
B.定容时,俯视容量瓶刻度线
C.配制前,容量瓶中有水珠
D.定容后摇匀发现液面下降,又向其中加水至刻度线
E.溶解磷酸时烧杯中的溶液未冷却至室温,即转移入容量瓶中加水定容。
查看答案和解析>>
科目: 来源: 题型:
【题目】以酸性氢氧燃料电池为电源进行电解的实验装置如图所示。下列说法正确的是( )
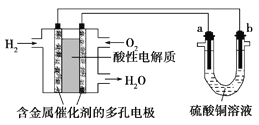
A. 燃料电池工作时,正极反应为O2+2H2O+4e-===4OH-
B. a极是粗铜,b极是纯铜时,a极逐渐溶解,b极上有铜析出
C. 电解过程中SO42— 移向b极
D. a、b两极若是石墨,在相同条件下a极产生的气体与电池中消耗的H2体积相等
查看答案和解析>>
科目: 来源: 题型:
【题目】在标准状况下,下列气体中含有氢原子质量最大的是
A. 0.5mol HCl B. 6.4g CH4 C. 6.72L NH3 D. 1.204![]() 1023个H2S
1023个H2S
查看答案和解析>>
科目: 来源: 题型:
【题目】工业制胆矾时,将粗制CuO粉末(含杂质FeO、Fe2O3)慢慢加入适量的稀H2SO4中完全溶解后,除去杂质离子后,再蒸发结晶可得纯净的胆矾晶体。已知:pH≥9.6时,Fe2+以Fe(OH)2的形式完全沉淀;pH≥6.4时,Cu2+以Cu(OH)2的形式完全沉淀;pH在3~4时,Fe3+以Fe(OH)3的形式完全沉淀.回答下列问题:
(1)为除去溶液中的Fe2+,可先加入______(填化学式)将Fe2+氧化为Fe3+,反应的离子方程式为__________,然后再加入适量的__________调整溶液的pH到______,使Fe3+转化为Fe(OH)3。
(2)甲同学怀疑调整至溶液pH=4是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp=1×10-38,Cu(OH)2的溶度积Ksp=3×10-20,通常认为残留在溶液中的离子浓度小于1×10-5 molL-1时就认为沉淀完全,设溶液中CuSO4的浓度为3molL-1,则Cu(OH)2开始沉淀时溶液的pH为______,Fe3+完全沉淀时溶液的pH为______,通过计算确定上述方案______ (填“可行”或“不可行”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图装置所示,C、D、E、F、X、Y均为惰性电极,甲、乙中溶液体积均为500mL且溶液浓度均相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极.将直流电源接通后,F极附近呈红色.请回答:

(1)B极是电源的_____极,一段时间后,甲中溶液颜色逐渐变____,丁中X极附近的颜色逐渐变浅,Y极附近的颜色逐渐变深,这表明Fe(OH)3胶体微粒带____荷。
(2)电解一段时间后甲、乙装置中的C、D、E、F电极均分别只有一种单质生成时,对应单质的物质的量之比为______________,乙中发生反应的化学方程式为__________________________________,若要使电解后的甲装置中的溶液恢复到原浓度则需加入一定量的_________(填化学式)。
(3)现用丙装置给铜件镀银,则H应该是______(填“镀层金属”或“镀件”),当镀件上析出5.4g银时, 甲、乙中溶液的pH分别为_____和_____
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法中正确的是
A. 2g D218O中所含中子数为NA
B. 2.24L Cl2通入足量H2O或NaOH溶液中转移的电子数均为0.1NA
C. 1mol/L碳酸氢钠溶液中的HCO3—数目小于NA
D. 一定条件下,39g的乙炔和苯的气体混合物中所含原子总数为6NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com