
科目: 来源: 题型:
【题目】氮、磷、砷是第VA族的元素,它们的单质及其化合物在生产生活中均有重要作用。请回答以下问题:
(1) 基态砷原子的最外层电子排布式为______;有_____个能级。
(2) N、P、As原子的第一电离能由大到小的顺序为________。
(3) 氮元素的一种重要化合物尿素CO(NH2)2分子中,σ键和π键的数目之比为______。
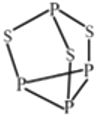
(4) P4S3 可用于制造火柴,其分子结构如图所示,判断P4S3 分子中硫原子的杂化轨道类型为_____,每个P4S3 分子中含孤电子对的数目为_______。
(5) Na3AsO4 可用作杀虫剂,AsO43-的空间构型为_______,与AsO43-互为等电子体的一种分子为_____ (填写化学式)。
(6) ①砷化镓(GaAs) 为黑灰色固体,熔点为1238℃,其晶胞结构如图所示。该晶体属于____晶体,微粒之间存在的作用力是_______。

② 砷化镓晶胞中距离Ga原子等距且最近的Ga原子有______个,已知砷化镓晶胞边长为apm,其密度为ρg·cm-3,则阿伏加德罗常数的值_______(列出计算式即可)。
查看答案和解析>>
科目: 来源: 题型:
【题目】钾长石(K2Al2Si6O16)通常也称正长石,主要用于生产玻璃、陶瓷制品,还可用于制取钾肥。某学习小组以钾长石为主要原料,从中提取氧化铝、碳酸钾等物质,工艺流程如下:
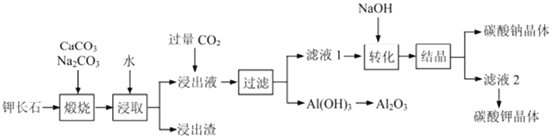
回答以下问题:
(1) 请以氧化物组成的形式表示钾长石的化学式为_____________
(2) 钾长石中的钾元素和铝元素在Na2CO3作用下转化为可溶性的KAlO2 和NaAlO2,写出Al2O3 转化为NaAlO2 的化学方程式_____________________。
(3) 已知“浸取”时应保持溶液呈碱性,分析其原因为____________(用离子方程式解释),若要提高浸取的速率,可采取的措施有_______________(回答一条)。
(4) 滤液1的主要成分是_________(填写化学式)
(5) 此工艺中可以循环利用的主要物质是________、___________和水。
(6) 以石墨为电极,通过电解Al2O3 可制得金属铝。电解池中接电源负极的一极的电极反应式是_______。长时间电解后,需要更换新的石墨电极的是___极(填“阴”或“阳”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】按要求回答下列问题:
Ⅰ、稀Na2S溶液有一种臭鸡蛋气味,加入AlCl3溶液后,臭鸡蛋气味加剧,用离子方程式表示气味加剧过程所发生的离子反应方程式_________________________________。
Ⅱ、常温下,向20mL 0.2molL﹣1H2A溶液中滴加0.2molL﹣1NaOH溶液.有关微粒的物质的量变化如下图(Ⅰ代表H2A,Ⅱ代表HA﹣,Ⅲ代表A2﹣)

(1)H2A在水中的电离方程式为_________________________。
(2)当V(NaOH)=20 mL时,写出H2A与NaOH反应的离子方程式_________________。此时溶液中所有离子浓度大小关系:__________________。
(3)向NaHA溶液中加水,HA﹣的电离度_________、溶液的pH________。(填增大、减小、不变、无法确定)。
(4)V(NaOH)=30 mL时,溶液中存在如下关系:2c(H+)﹣2c(OH﹣)________2c(A2﹣)﹣3c(H2A)﹣c(HA﹣)(填“<”“>”或“=”)。
(5)某校研究性学习小组开展了题为“H2A是强酸还是弱酸的实验研究”的探究活动。该校研究性学习小组设计了如下方案:你认为下述方案可行的是_______(填编号);
A.测量浓度为0.05 mol/L H2A溶液的pH,若pH大于1,则可证明H2A为弱电解质
B.可测NaHA溶液的pH。若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸
C.比较中和等体积、等物质的量浓度的硫酸和H2A溶液所需氢氧化钠的量多少,可证明H2A是强酸还是弱酸。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知常温时HClO的Ka=3.0×10-8,HF的Ka=3.5×10-4。现将pH和体积都相同的次氯酸和氢氟酸溶液分别加蒸馏水稀释,pH随溶液体积的变化如图所示。下列叙述正确的是
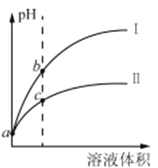
A. 曲线I为次氯酸稀释时pH变化曲线
B. 取a点的两种酸溶液,中和相同体积、相同浓度的NaOH溶液,消耗次氯酸的体积较小
C. a点时,若都加入相同大小的锌粒,此时与氢氟酸反应的速率大
D. b点溶液中水的电离程度比c点溶液中水的电离程度小
查看答案和解析>>
科目: 来源: 题型:
【题目】人工肾脏可用电化学方法除去代谢产物中的尿素[CO(NH2)2],原理如图所示。下列有关说法不正确的是
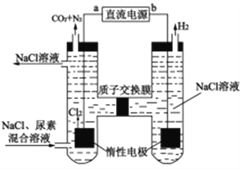
A. a为直流电源的正极
B. 阳极室中发生的电极反应式有2Cl--2e-=Cl2↑
C. 电解结束后,阴极室溶液的pH将降低
D. 若两极共收集到气体13.44L(标准状况),混合溶液可除去尿素7.2g(忽略气体的溶解)
查看答案和解析>>
科目: 来源: 题型:
【题目】请按要求回答下列问题:
Ⅰ.硫酸铜晶体的溶解度虽大,但溶解过程较慢,实验室常用热水配制以加快溶解速率,但常常会产生浑浊,请用文字简要说明原因_____________,如何才能用热水配制出澄清的较浓的CuSO4溶液_______________;
Ⅱ.依据反应:MnO4-+5Fe2++8H+ = Mn2++5Fe3++4H2O,采用滴定的方法测定FeSO4的质量分数,实验步骤如下:
滴定前的准备:
①→ 用蒸馏水清洗 → 用待装溶液润洗 → 装液→ ② → 调节液面在零刻度或零刻度以下 → 记录初始读数
①称量绿矾样品质量为m g,配成100 mL待测溶液,②取体积为10.00mL的待测液置于锥形瓶中,并加入一定量的硫酸,③将标准浓度为1.0molL﹣1的KMnO4溶液装入滴定管中,调节液面至a mL处,④滴定待测液至滴定终点时,滴定管的液面读数b mL,⑤重复滴定2~3次。
请回答下列问题:
(1)将步骤1中的操作补充完整:
①__________________________,②__________________________
(2)KMnO4(H+)溶液应装入______式滴定管进行滴定;如何知道滴定到达终点?___________
(3)下列操作会导致测定结果偏低的是____________________
A.盛标准溶液的滴定管用蒸馏水洗涤后未用标准液润洗就装液滴定
B.锥形瓶用蒸馏水洗涤后未用待测液润洗
C.读取标准液读数时,滴定前平视,滴定到终点后俯视
D.滴定后滴定管尖嘴处悬有溶液未滴落
(4)实验测得FeSO4的质量分数为____________(用含a、b的代数式表示)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验操作所对应的现象以及结论都正确的是
选项 | 实验操作 | 现象 | 结论 |
A | 用坩埚钳夹住一小块用砂纸打磨过的铝箔,在酒精灯上加热 | 铝箔熔化并滴落 | 金属铝的熔点较低 |
B | 先向某溶液滴加H2O2,然后再滴加几滴KSCN溶液 | 溶液变为红色 | 该溶液中一定含有Fe2+ |
C | 在KI溶液中滴加少量氯水,再加入CCl4,充分振荡 | 液体分层,下层溶液呈紫红色 | 氯的非金属性强于碘 |
D | 向1mL0.1mol/LMgCl2溶液中先滴1~2滴2mol/LNaOH溶液,再滴加2滴0.1mol/L FeCl3溶液,静置 | 先有白色沉淀生成,后白色沉淀变为红褐色 | Ksp[Mg(OH)2]<Ksp[Fe(OH)3] |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列叙述正确的是
A. 标准状况下,33.6L氦气所含的原子数目是3NA
B. 2.2gKHCO3与Mg3N2的混合物中含有的质子数目为1.1NA
C. 0.3molNaHSO4固体在熔融状态下所含的SO42-数目为0.3NA
D. 25℃时,1LpH=12的Na2CO3溶液中含有Na+的数目为0.02NA
查看答案和解析>>
科目: 来源: 题型:
【题目】已知铅蓄电池的工作原理为Pb+PbO2+2H2SO4 ![]() 2PbSO4+2H2O,现用如图装置进行电解(电解液足量),电解中发现Ag电极有气体产生。请回答下列问题。
2PbSO4+2H2O,现用如图装置进行电解(电解液足量),电解中发现Ag电极有气体产生。请回答下列问题。

甲池 乙池
(1)B是铅蓄电池的________极,放电过程中A电极反应式:_______________________。
(2)电解后甲池中电解液的pH________(填“减小”“增大”或“不变”)。若甲池中产生气体11.2L(标准状况下),此时乙池中理论上Zn电极最多产生固体________ g。
(3)乙池中 C(碳)电极是_________极。C电极的电极反应式是___________________,反应一段时间后,向乙池中加入一定量的___________(填化学式)固体,能使CuSO4溶液恢复到原浓度。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com