
科目: 来源: 题型:
【题目】如图装置所示,C、D、E、F、X、Y均为惰性电极,甲、乙中溶液体积均为500mL且溶液浓度均相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极.将直流电源接通后,F极附近呈红色.请回答:

(1)B极是电源的_____极,一段时间后,甲中溶液颜色逐渐变____,丁中X极附近的颜色逐渐变浅,Y极附近的颜色逐渐变深,这表明Fe(OH)3胶体微粒带____荷。
(2)电解一段时间后甲、乙装置中的C、D、E、F电极均分别只有一种单质生成时,对应单质的物质的量之比为______________,乙中发生反应的化学方程式为__________________________________,若要使电解后的甲装置中的溶液恢复到原浓度则需加入一定量的_________(填化学式)。
(3)现用丙装置给铜件镀银,则H应该是______(填“镀层金属”或“镀件”),当镀件上析出5.4g银时, 甲、乙中溶液的pH分别为_____和_____
查看答案和解析>>
科目: 来源: 题型:
【题目】对于反应3Cl2+6NaOH==5NaCl+NaClO3+3H2O,以下叙述正确的是( )
A. Cl2是氧化剂,NaOH是还原剂
B. 被氧化的Cl原子和被还原的Cl原子的物质的量之比为5∶1
C. Cl2既做氧化剂又做还原剂
D. 氧化剂得电子数与还原剂失电子数之比为5∶1
查看答案和解析>>
科目: 来源: 题型:
【题目】制备乙炔的电石渣对环境污染极为严重,因此需要对水体进行净化处理。现取500mL电石渣废水(阳离子主要为Ca2+),测定水质的数据如下表所示。

注:SS表示固体悬浮物
模拟工业处理流程如下:
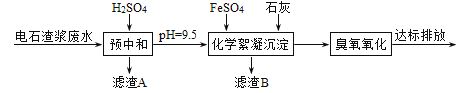
已知:i.常温时CaSO4微溶于水; ii.溶解度: CaSO4>Fe(OH)2>FeS。
(1)①采用20%的硫酸对废水进行预中和处理,pH变化如下图所示。硫酸的用量和废水中固体悬浮物(SS)含量的关系是_______。

②废水中SS含量随时间变化如下表所示。
静置时间(h) | 1 | 2 | 3 | 4 | 5 | 6 | 24 |
SS含量(mg/L) | 2500 | 1800 | 1300 | 900 | 820 | 800 | 780 |
为降低成本,减少硫酸投加量的最好办法是_______。
③滤渣A的主要成分有SS和_______。
(2)根据表中数据,回答下列问题。

①化学絮凝沉淀过程中,加入FeSO4发生反应的离子方程式是______。
②熟石灰能促进沉淀的生成,结合离子方程式,从平衡角度分析其原因是_______。
(3)用臭氧进一步处理废水中的氰化物和残留硫化物,若将500mL废水中的CN-完全氧化成N2和CO2,转移______mol e-。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,探究铜与稀HNO3,反应过程如下:
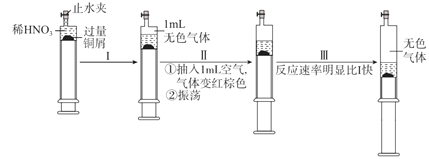
下列说法不正确的是
A. 过程I中生成无色气体的离子方程式是3Cu+2 NO3-+8H+ =3Cu2++2NO↑+4H2O
B. 步骤III反应速率比I快的原因是NO2溶于水,使c(HNO3)增大
C. 由实验可知,NO2对该反应具有催化作用
D. 当活塞不再移动时,再抽入空气,铜可以继续溶解
查看答案和解析>>
科目: 来源: 题型:
【题目】ClO2是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4![]() 2ClO2↑+K2SO4+2CO2↑+2H2O,下列说法正确的( )
2ClO2↑+K2SO4+2CO2↑+2H2O,下列说法正确的( )
A. 1 molKClO3参加反应有1mole- 转移 B. ClO2是氧化产物
C. H2C2O4在反应中被还原 D. KClO3在反应中得到电子,作还原剂
查看答案和解析>>
科目: 来源: 题型:
【题目】盐在化学工业中有重要的应用,请回答下列问题:
(1)用化学方程式表示配制FeCl3溶液时常加入浓盐酸的原因______________________________________________
(2)常温下,在pH=3的Al2(SO4)3溶液与pH=11的Na2S溶液中,水电离出来的c(OH﹣)之比为______,将两溶液混合后,产生白色沉淀和有臭鸡蛋味的气体,其反应的离子方程式为_________________________
(3)c(NH4+)相等的下列溶液①NH4Cl ②NH4HSO4 ③(NH4)2SO4 ④CH3COONH4 ⑤NH3·H2O,溶液的物质的量浓度由小到大的顺序是______________________________________________________ (用序号表示)
(4)已知t℃时①AgCl的Ksp=2×10﹣10;②在t℃时,Ag2CrO4在水中的沉淀溶解平衡曲线如图所示.下列正确的是_______

A.在饱和Ag2CrO4溶液中加入K2CrO4可使溶液由Y点到X点
B.在t℃时Ag2CrO4的Ksp为1×10-12
C.在t℃时反应:Ag2CrO4(s)+2Cl-(aq)![]() 2AgCl(s)+CrO42-(aq)的平衡常数为2.5×107
2AgCl(s)+CrO42-(aq)的平衡常数为2.5×107
D.在t℃时以0.01mol/L的AgNO3溶液滴定20mL浓度均为0.01mol/L的KCl和K2CrO4的混合溶液,CrO42-先沉淀
查看答案和解析>>
科目: 来源: 题型:
【题目】我国研究锂硫电池获得突破,电池的总反应是16Li+S8 ![]() 8Li2S ,充放电曲线如图所示,下列说法不正确的是( )
8Li2S ,充放电曲线如图所示,下列说法不正确的是( )
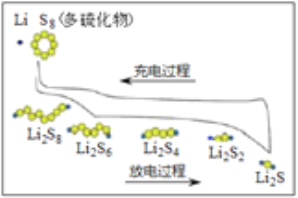
A. 充电时,电能转化为化学能
B. 放电时,锂离子向正极移动
C. 放电时,1mol Li2S6转化为Li2S4得到2mole-
D. 充电时,阳极总电极反应式是8S2- -16e- = S8
查看答案和解析>>
科目: 来源: 题型:
【题目】已知下列分子或离子在酸性条件下都能氧化KI,自身发生如下变化:
H2O2→H2O IO3-→I2 MnO4-→Mn2+ HNO2→NO
如果分别用等物质的量的这些物质氧化足量的KI,得到I2最多的是( )
A.H2O2
B.IO3-
C.MnO4-
D.HNO2
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,将0.1molCH3COONa和0.05molHCl溶于水配成1L溶液(pH<7).
(1)用离子方程式表示该溶液中存在的三个平衡体系______________、_______________、___________________
(2)溶液中各离子的物质的量浓度由大到小顺序为_____________________________________________________
(3)溶液中粒子中浓度为0.1mol/L的是________________,浓度为0.05mol/L的是____________________
(4)物质的量之和为0.lmol的两种粒子是______________与__________
(5)CH3COO-和OH-的物质的量之和比H+多________mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com