
科目: 来源: 题型:
【题目】下列离子在溶液中因水解反应而不能大量共存的是
A. H+ 、 Cl- 、 OH- 、 Na+
B. Fe3+ 、NO3- 、S2-、 Na+
C. Ba2+ 、Al3+ 、 K+ 、 〔Al(OH)4 〕-
D. NH4+ 、CO32-、 K+ 、Cl-
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式书写不正确的是
A.用两块铜片作电极电解盐酸:Cu + 2H+ ![]() H2↑ + Cu2+
H2↑ + Cu2+
B.NaOH溶液与足量的Ca(HCO3)2溶液反应:2HCO3- + 2OH- + Ca2+==CaCO3↓+ 2H2O
C.等物质的量的FeBr2和Cl2在溶液中的反应:2Fe2+ + 2Br - + 2Cl2==2Fe3+ + Br2 + 4Cl -
D.氨水吸收少量的二氧化硫:2NH3·H2O + SO2==2NH4+ +SO32- + H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】化学与生活关系密切。下列关于生活中常见物质的说法,不正确的是( )
A.羊毛、蚕丝、塑料、合成橡胶都属于有机高分子材料
B.天然植物油没有恒定的熔沸点,常温下难溶于水
C.所有的油脂、糖类和蛋白质都能发生水解反应
D.麦芽糖及其水解产物均能发生银镜反应
查看答案和解析>>
科目: 来源: 题型:
【题目】合成药物中间体M的流程如下。
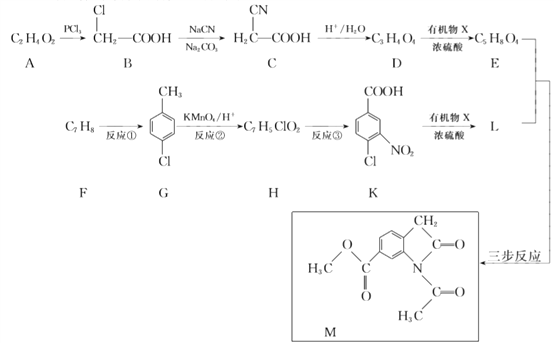
已知:
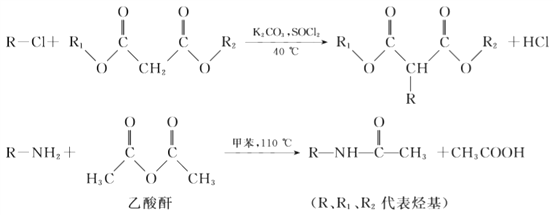
(1)A的名称是________。
(2)B中含有的官能团是________。
(3)D的结构简式是________。
(4)反应①的化学方程式是________。
(5)反应②的反应类型是________。
(6)反应③的试剂和条件是________。
(7)由K生成L反应的化学方程式是________
(8)
写出中间产物的结构简式: 中间产物Ⅰ ______ , 中间产物Ⅱ ______。
查看答案和解析>>
科目: 来源: 题型:
【题目】对于反应KMn04+ HCl—KC1+ MnCl2+Cl2+ H20(未配平),若有0.1 mol KMn04参加反应,下列说法正确的是 ( )
A. 转移0.5 mol电子 B. 生成0.5 mol Cl2
C. 参加反应的HC1为1.6 mol D. Cl2是还原产物
查看答案和解析>>
科目: 来源: 题型:
【题目】为增大铁片与硫酸制取H2的化学反应速率,下列措施中不能达到目的的是
A.用铁粉代替铁片B.用浓硫酸代替稀硫酸
C.向反应体系中滴加少量CuSO4溶液D.适当升高溶液温度
查看答案和解析>>
科目: 来源: 题型:
【题目】工业制胆矾时,将粗制CuO粉末(含杂质FeO、Fe2O3)慢慢加入适量的稀H2SO4中完全溶解后,除去杂质离子后,再蒸发结晶可得纯净的胆矾晶体。已知:pH≥9.6时,Fe2+以Fe(OH)2的形式完全沉淀;pH≥6.4时,Cu2+以Cu(OH)2的形式完全沉淀;pH在3~4时,Fe3+以Fe(OH)3的形式完全沉淀.回答下列问题:
(1)为除去溶液中的Fe2+,可先加入______(填化学式)将Fe2+氧化为Fe3+,反应的离子方程式为__________,然后再加入适量的__________调整溶液的pH到______,使Fe3+转化为Fe(OH)3。
(2)甲同学怀疑调整至溶液pH=4是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp=1×10-38,Cu(OH)2的溶度积Ksp=3×10-20,通常认为残留在溶液中的离子浓度小于1×10-5 molL-1时就认为沉淀完全,设溶液中CuSO4的浓度为3molL-1,则Cu(OH)2开始沉淀时溶液的pH为______,Fe3+完全沉淀时溶液的pH为______,通过计算确定上述方案______ (填“可行”或“不可行”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】溴化锂是一种高效的水汽吸收剂,其一种绿色工业合成工艺如下(部分操作和条件已略去)。
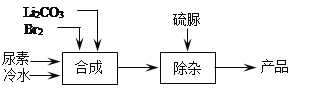
已知:碳酸锂微溶于水,水溶液显碱性。
(1)Br2的电子式是______。
(2)合成过程中发生的反应如下,请写出ii反应的化学方程式并将iii补充完整。
ⅰ. Br2 +H2O![]() HBr +HBrO;
HBr +HBrO;
ⅱ._____;
ⅲ. 3LiBrO + CO(NH2)2(尿素)=3LiBr+_____。
(3)LiBrO3是生产过程中的副产物。
①用化学方程式表示生成改副产物的原因:______。
②为了提高原料的利用率,减少副产物的生成,必须调控体系的pH在3~5之间,通过合理的加料方法来实现:将碳酸锂粉末溶解于冷的溴水中至饱和,并一次性加入尿素,然后再______,直到尿素完全转化。
③常用硫脲除去LiBrO3,反应的化学方程式是4LiBrO3 +3CS(NH2)2(硫脲) +3H2O=4LiBr +3CO(NH2)2 +3H2SO4 ,选用硫脲除杂的优点是_______;缺点是引入新杂质且溶液酸性增强,为解决该问题需要加入的试剂是_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】某兴趣小组利用电解装置,探究“铁作阳极”时发生反应的多样性,实验过程如下。
I.KCl作电解质
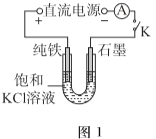
(1)一定电压下,按图-1装置电解,现象如下:
石墨电极上迅速产生无色气体,铁电极上无气体生成,铁逐渐溶解。
5min后U型管下部出现灰绿色固体,之后铁电极附近也出现灰绿色固体,10min后断开K。按图-2进行实验。
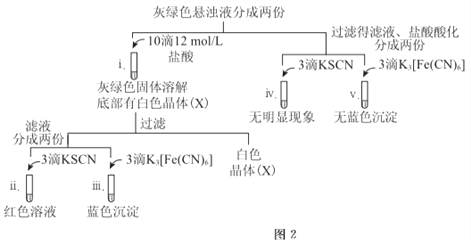
①石墨电极上的电极反应式是________。
②确认灰绿色固体中含有Fe2+的实验现象是_______。
③灼烧晶体X,透过蓝色钴玻璃观察到火焰呈紫色。结合平衡移动原理,解释“试管i中析出白色晶体”的原因是_______。
(2)其他条件不变时,用图-3装置重复实验,10min后铁电极附近溶液依然澄清,断开K。按图-4进行实验
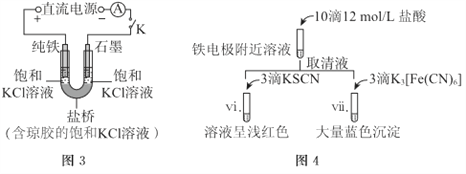
①盐桥的作用是_______。
②与实验I中vi、vii与ii~v中的现象比较,可以得出的结论是(答两点):_______。
II.KOH作电解质
(3)用图-1装置电解浓KOH溶液,观察到铁电极上立即有气体生成,附近溶液逐渐变为淡紫色(![]() ),没有沉淀产生。
),没有沉淀产生。
①铁电极上OH-能够放电的原因是______。
②阳极生成![]() 的总电极反应式是______。
的总电极反应式是______。
③某同学推测生成![]() 的必要条件是浓碱环境,将图-5中的实验方案补充完整,证实推测成立。
的必要条件是浓碱环境,将图-5中的实验方案补充完整,证实推测成立。
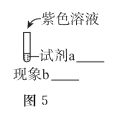 ______
______
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于金属冶炼的说法正确的是
A.由于铝的金属性强,故工业上采用电解熔融AlCl3的方法生产单质铝
B.将钠投入氯化镁饱和溶液中,可置换出镁单质
C.根据金属的活泼性不同,采用不同的金属冶炼方法
D.铝热反应需要在高温下进行,是一个典型的吸热反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com