
科目: 来源: 题型:
【题目】诺卜醇可用于调制木香型化妆品及皂用香精。一种制备方法如图所示,下列说法正确的是

A. 可用溴的CCl4溶液区别β-蒎烯与诺卜醇
B. β-蒎烯的饱和碳原子上的一氯代物最多有7种
C. β-蒎烯和诺卜醇分子中都有一个由5个碳原子构成的四面体
D. 可用乙酸检验β-蒎烯是否含有诺卜醇
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述中,一定能判断化学平衡移动的是
A. 混合物中各组分的浓度改变
B. 正、逆反应速率改变
C. 混合物中各组分的百分含量改变
D. 混合体系的压强改变
查看答案和解析>>
科目: 来源: 题型:
【题目】某课外兴趣小组需要用 18 mol/L 的浓硫酸配制80mL 3.0 mol/L 稀硫酸的实验步骤如下: ① 计算所用浓硫酸的体积 ② 量取一定体积的浓硫酸 ③ 稀释 ④ 检漏、 转移、洗涤⑤ 定容、摇匀 回答下列问题:
(1)所需浓硫酸的体积是__________ mL, 量取浓硫酸所用的量筒的规格是___________ (用下列编号填空) 。
A.10 mL B.25 mL C.50 mL D.100 mL
(2)第⑤步实验的操作是继续向容量瓶中注入蒸馏水至离刻度线__________, 改用___________向容量瓶中滴加蒸馏水至_________________________为止。塞紧瓶塞,倒转摇匀并转移至试剂瓶中。
(3)下列情况对所配制的稀硫酸浓度有何影响? (填 “ 偏大 ”“ 偏小 ” 或 “ 无影响”)
①容量瓶用蒸馏水洗涤后残留有少量的水_________________
②在转入容量瓶前烧杯中溶液未冷却至室温_________
③取完浓硫酸后洗涤量筒,并把洗涤液倒入烧杯___________。
④定容结束时俯视刻度线_______________
查看答案和解析>>
科目: 来源: 题型:
【题目】前几日的学业水平测试时期,因温度骤降,许多学生使用上了“暖宝宝。暖宝宝采用的是铁的“氧化放热”原理,使其发生原电池反应。已知制作暖宝宝的原料有铁粉、水、活性炭、蛭石和食盐,铁粉在原电池中充当
A. 负极 B. 正极 C. 阳极 D. 阴极
查看答案和解析>>
科目: 来源: 题型:
【题目】现有下列十种物质:①H2 ②铝 ③CaO固体 ④CO2 ⑤H2SO4 ⑥Ba(OH)2 ⑦熔融的KNO3 ⑧氨水 ⑨稀硝酸 ⑩Al2(SO4)3
(1)上述十种物质中有两种物质之间可发生离子反应:H++OH﹣=H2O,该离子反应对应的化学方程式为____________________________________。
(2)⑩在水中的电离方程式为___________________________。
(3)以上属于电解质的共有____________种。
(4)将少量的④通入⑥的溶液中反应的离子方程式为___________________________。
(5)配平② 与 ⑨发生反应的化学方程式,并用双线桥法标明该反应中电子转移的方向和数目____Al + ___HNO3 = ___Al(NO3)3 + ___NO↑ +__ ______ ;当有8.1g Al发生反应时,转移电子的物质的量为__________mol,HNO3的作用是酸和氧化剂其物质的量之比为_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】水溶液是中学化学的重点研究对象
(1)水是极弱的电解质,也是最重要的溶剂。常温下某电解质溶解在水中后,溶液中的c(H+)=10-9mol·L-1,则该电解质可能是______(填序号)。
A. CuSO4 B. HCl C. Na2S D.NaOH E.K2SO4
(2)已知次氯酸是比碳酸还弱的酸,要使新制稀氯水中的c(HC1O)增大,可以采取的措施为(至少回答两种)________________________________________。
(3)常温下,将pH=3的盐酸a L分别与下列三种溶液混合,结果溶液均呈中性。
①浓度为1.0×10-3mol.L-1的氨水b L;②c(OH -)=1.0×10-3mol·L-l的氨水cL;③c(OH-)=1.0×10-3mol·L-1的氢氧化钡溶液d L。则a、b、c、d之间的关系是___________________________________。
(4)强酸制弱酸是水溶液中的重要经验规律。
已知HA、H2B是两种弱酸,存在以下关系:H2B(少量)+2A-=B2-+2HA,则A-、B2-、HB-三种阴离子结合H+的难易顺序为_______________________。
(5)已知:H2A═H++HA-、HA-![]() H++A2-,常温下,0.1mol·L-1的NaHA溶液其pH=2,则0.1mol·L-1的H2A溶液中氢离子浓度的大小范围是:____________;NaHA溶液中各种离子浓度大小关系为_______________________。
H++A2-,常温下,0.1mol·L-1的NaHA溶液其pH=2,则0.1mol·L-1的H2A溶液中氢离子浓度的大小范围是:____________;NaHA溶液中各种离子浓度大小关系为_______________________。
(6)己知:Ksp(AgCl)=1.8×10-10,向50mL 0.018mo1`L-l的AgNO3溶液中加入相同体积0.020mol`L-1的盐酸,则c(Ag+)=____________,此时所得混合溶液的pH=__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】甲、乙两烧杯中各盛有100mL3mol/L的硫酸和氢氧化钠溶液,向两烧杯中分别加入A克的铝粉,反应结束后测得生成的气体体积为甲:乙=3:4,下列说法正确的是( )
A. 参加反应的H2SO4为0.2mol B. 参加反应的NaOH约为0.27mol
C. 加入铝粉的质量A=5.4 D. 与硫酸反应的铝粉的质量7.2g
查看答案和解析>>
科目: 来源: 题型:
【题目】I.有机物A的结构简式是 ,它可以通过不同的反应得到下列物质:
,它可以通过不同的反应得到下列物质:
B.  C.
C. 
D.  E.
E. 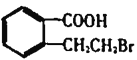
(1)A中含氧官能团的名称:_____________________________。
(2)写出由A制取B的化学方程式:_____________________________。
(3)写出A制取C、D、二种物质的有机反应类型:
A制C:_____________反应,A 制 D :_________________反应
(4)写出一种既可以看做酯类又可以看做酚类,且分子中苯环上连有三种取代基的A的同分异构体的结构简式:______________________________。
Ⅱ.F、G都是有机化合物,请回答下列问题:
(1)已知:6.0g化合物F完全燃绕生成8.8gCO2和3.6gH2O;F的蒸气对氢气的相对密度为30,则F的分子式为__________________________。
(2)G的分子式是C8H8Br2,在G的同分异构体中,苯环上一硝化的产物只有一种的共有_______个,其中核磁共振氢谱有两组峰,且峰面职比为l∶l的是_______(填结构简式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.在有机化学分析中,根据反应的性质和反应产物,即可确定烯烃的组成和结构(双键及支链的位置),例如:
据以上线索和下列反应事实,确定C7H14的结构和名称:

(1)该烃的结构简式是_______________________________。
(2)名称是_______________________________。
Ⅱ.把不饱和烃在催化剂存在下用O3氧化则生成有羰基的化合物,其规律可用下式表示:![]() 。现把一定量的以分子式为C4H8的不饱和烃的混合体。用上述方法进行氧化,生成0.5mol酮,1.5mol醛,其中含甲醛0.7mol,另外把1.0mol混合气体进行加氢反应,生成1.0mol饱和烃的混合气体。则上述混合气体经臭氧氧化后 可生成的物质:(用结构简式表示):_________________。
。现把一定量的以分子式为C4H8的不饱和烃的混合体。用上述方法进行氧化,生成0.5mol酮,1.5mol醛,其中含甲醛0.7mol,另外把1.0mol混合气体进行加氢反应,生成1.0mol饱和烃的混合气体。则上述混合气体经臭氧氧化后 可生成的物质:(用结构简式表示):_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示,两个连通容器用活塞分开,左右两室体积相同,左室充入一定里NO,右室充入一定量O2,且恰好使两容器内气体密度相同。打开活塞,使NO与O2充分反应,下列判断正确的是(不考虑NO2转化为N2O4) ( )
![]()
A.反应前后左室的压强相同
B.开始时左右两室中的分子数相同
C.反应后容器内的密度与反应前的相同
D.反应后容器内无O2存在
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com