
科目: 来源: 题型:
【题目】(1)铁及其化合物在生活、生产中有广泛的应用。请回答下列问题:
①黄铁矿(FeS2,二硫化亚铁)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为3FeS2+8O2=6SO2+Fe3O4,氧化产物为_____,若有3mol FeS2参加反应,转移__________mol电子。
②FeCl3与氢碘酸反应时可生成棕色物质I2,该反应的离子方程式为_________________。
(2)对反应NH3+O2—NO+H2O(未配平,反应条件略去)作分析,该反应中,还原剂是_______,还原产物是________,被还原的物质是_________。参加反应的氧化剂为3.2g时,反应转移的电子的物质的量为________________。
(3)对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施。含氰废水中的CN-有剧毒。在微生物的作用下,CN-能够被氧气氧化成HCO![]() ,同时生成NH3,该反应的离子方程式为____________(提示:反应过程中N元素化合价不发生改变)。
,同时生成NH3,该反应的离子方程式为____________(提示:反应过程中N元素化合价不发生改变)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某工厂的工业废水中含有大量的FeSO4,较多的CuSO4和少量Na2SO4。为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁和金属铜。请根据下列流程图,完成回收硫酸亚铁和铜的实验方案。

(1)加入的试剂①为______(填化学式),加入试剂①的目的是______。
(2)操作a的名称为过滤、洗涤,所需要的玻璃仪器为______。洗涤固体B的操作是________。
(3)固体E的成分为_____,加入的试剂④为_____,发生的化学方程式为_________。
(4)从溶液D和溶液G中得到FeSO47H2O晶体的操作为______、______、______、洗涤、干燥。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A. MnO2+ 4HCl(浓)![]() MnCl2 +Cl2↑ + 2H2O中,氧化剂和还原剂物质的量之比为1∶4
MnCl2 +Cl2↑ + 2H2O中,氧化剂和还原剂物质的量之比为1∶4
B. 2H2S+ SO2=3S+2H2O中,氧化产物和还原产物物质的量之比为1∶1
C. 3S+ 6KOH=2K2S+ K2SO3+3H2O中,被氧化和被还原的硫元素物质的量之比为2∶1
D. Al2O3+N2+3C![]() 2AlN+3CO中,氧化剂和还原剂物质的量之比为1∶3
2AlN+3CO中,氧化剂和还原剂物质的量之比为1∶3
查看答案和解析>>
科目: 来源: 题型:
【题目】请按要求回答下列问题:
I.25℃时,物质的量浓度均为0.1mol/L的几种盐溶液的pH如表:
序号 | ① | ② | ③ | ④ |
溶液 | NH4Cl | CH3COONH4 | NaHCO3 | Na2CO3 |
pH | 5 | 7 | 8.4 | 11.6 |
(1)用离子方程式解释溶液④能去除油污的原因________________________。
(2)写出溶液③中电荷守恒的关系式:_________________________________________。
(3)25℃时,溶液①中,由水电离产生的c(OH-)=_______mol/L;
根据溶液②,Ka(CH3COOH )_____Kb(NH3·H2O) (填“>”、“<”或“=”)。
II.根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2) 表面与水发生下列反应,
(1)已知: N2(g) + 3H2(g)![]() 2NH3(g) △H=-92.4kJ·mol-1
2NH3(g) △H=-92.4kJ·mol-1
2H2(g) + O2(g)= 2H2O (1) △H =-571.6kJ·mol-1
则2N2(g) + 6H2O(1)![]() 4NH3(g) + 3O2(g) △H=______。
4NH3(g) + 3O2(g) △H=______。
(2)氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得: 3SiO2(s)+ 6C(s) + 2N2(g) ![]() Si3N4(s)+ 6CO(g)。该反应的平衡常数表达式为K=_________。
Si3N4(s)+ 6CO(g)。该反应的平衡常数表达式为K=_________。
(3)以N2和H2为反应物(如下图),盐酸酸化的NH4Cl溶液为电解质的原电池,a电极的电极反应式为:____________________________________________。
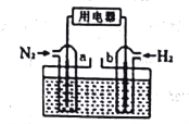
查看答案和解析>>
科目: 来源: 题型:
【题目】某白色粉末由两种物质组成,为鉴别其成分进行如下实验:
①取少量样品加入足量水仍有部分固体未溶解;再加入足量稀盐酸,有气泡产生,固体全部溶解;
②取少量样品加入足量稀硫酸有气泡产生,振荡后仍有固体存在。
该白色粉末可能为( )
A. ![]() 、
、![]() B. AgCl、
B. AgCl、![]()
C. ![]() 、
、![]() D.
D. ![]() 、
、![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】糖类、油脂、蛋白质是人类重要的营养物质。下列有关这三类物质的说法正确的是
A.均是天然高分子化合物B.均只由C、H、O三种元素组成
C.蛋白质是热值最高的营养物质D.淀粉、油脂、蛋白质在一定条件下均能发生水解反应
查看答案和解析>>
科目: 来源: 题型:
【题目】CoCO3是一种制造锂电池电极的原料。以含钴废渣(主要成分CoO、Co2O3,还含有Al2O3、 ZnO等杂质)为原料制备CoCO3的一种工艺流程如下:
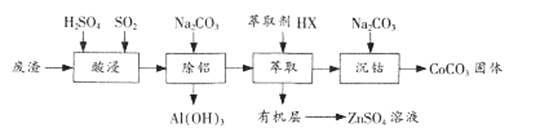
①相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol/L计算)

②钴元素常见的化合价为+2、+3,+2钴有较强的还原性。
③+3钴的化合物一般呈现粉红—红色。
④Ksp[Co(OH)2]=1.58×10-15 Ksp[CoCO3]=1.4×10-13
(1)“酸浸”时通人SO2的目的是 ___________。
(2)“除铝”时调节溶液pH范围为 ________,该过程中主要反应的离子方程式为___________________。
(3)“萃取”过程可表示为ZnSO4(水层)+2HX(有机层)![]() ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是 ___________________。
ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是 ___________________。
(4)“沉钴”时Na2CO3溶液需缓慢滴加的原因是 ____________________。
(5)CoCO3隔绝空气灼烧可以生成Co2O3,该反应的化学方程式为____________________。
(6)在CoCO3中先加入几滴丙酮,再边振荡边逐滴加入浓氨水,沉淀逐渐由粉红色变为土黄色的含Co(NH3)6 2+的溶液,向溶液中缓缓通入一定量的氧气,溶液最终变为红色。
①加入丙酮的作用__________________________;②若在该红色溶液中滴加足量的浓盐酸生成标准状况下2.24L C12,则之前往土黄色的溶液中至少应通入标准状况下__________________________升空气(空气中氧气体积分数为0.20)。
查看答案和解析>>
科目: 来源: 题型:
【题目】室温下,用相同浓度的NaOH溶液,分别滴定浓度均为0.1mol·L-1的三种酸(HA、HB和HD)溶液,滴定的曲线如图所示,下列判断错误的是( )

A. 三种酸的电离常数关系:KHA>KHB>KHD
B. 滴定至P点时,溶液中:c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-)
C. pH=7时,三种溶液中:c(A-)=c(B-)=c(D-)
D. 当中和百分数达100%时,将三种溶液混合后:c(HA)+c(HB)+c(HD)=c(OH-)-c(H+)
查看答案和解析>>
科目: 来源: 题型:
【题目】用0.100molL-1的盐酸滴定10ml0.100molL-1的Na2CO3溶液.溶液pH值与加入盐酸的体积的关系如图所示,已知室温时饱和CO2的pH为3.9,0.05molL-1NaHCO3的pH约为8.3,下列说法不正确的是
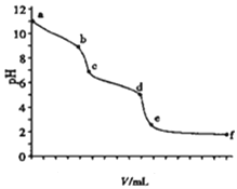
A. 以酚酞为指示剂,溶液颜色发生突变时(b点),Na2CO3转化为NaHCO3
B. 以甲基橙为指示剂,溶液颜色发生突变时,共消耗盐酸20.00ml
C. 溶液pH=7(c点),碳酸钠完全转化为NaCl
D. ce段对应溶液中CO2与NaHCO3共存
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com