
科目: 来源: 题型:
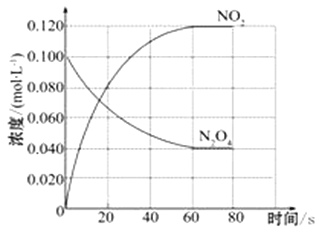
【题目】在容积为1.00 L的容器中,通入一定量的N2O4,发生反应N2O4(g) ![]() 2NO2(g),随温度升高,混合气体的颜色变深。
2NO2(g),随温度升高,混合气体的颜色变深。
回答下列问题:
(1)反应的△H___________0(填“大于”“小于”);100℃时,体系中各物质浓度随时间变化如上图所示。在0~60s时段,反应速率v(N2O4)为_____________molL-1s-1,反应的平衡常数K1为______________。
(2)100℃时达到平衡后,改变反应温度为T,c(N2O4)以0.0020 molL-1s-1的平均速率降低,经10 s又达到平衡。
① T __________100℃(填“大于”“小于”),判断理由是______________________________________;
② 温度T时反应的平衡常数K2 为 ___________________。
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向______________(填“正反应”或“逆反应”)方向移动。
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组利用还原铁粉处理含Fe(NO3)3、Cu(NO3)2、HNO3的废水,所加还原铁粉的质量与溶液中Fe2+的浓度变化关系如下图(忽略溶液体积变化)。下列有关结论错误的是( )
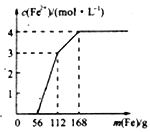
A. 加入铁粉质量小于56g时发生的反应为Fe+NO3-+4H+=Fe3++NO↑+2H2O
B. 当加入的铁粉质量超过168g后,溶液中的溶质只含有Fe(NO3)2(忽略Fe2+的水解)
C. 原废水中Fe(NO3)3的浓度为2mol/L,Cu(NO3)2的浓度均为1mol/L
D. 原废水中三种物质的氧化性由强到弱的顺序是HNO3>Fe(NO3)3>Cu(NO3)2
查看答案和解析>>
科目: 来源: 题型:
【题目】已知常温时HClO的Ka=3.0×10-8,HF的Kb=3.5×10-4。现将pH和体积都相同的次氯酸和氢氟酸溶液分別加蒸馏水稀释,pH随溶液体积的变化如图所示,下列叙述正确的是( )
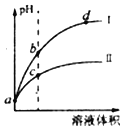
A. 曲线Ⅰ为次氯酸稀释时pH变化曲线
B. 取a点的两种酸溶液,中和相同体积、相同浓度的NaOH溶液,消耗氢氟酸的体积较小
C. b点溶液中水的电离程度比c点溶液中水的电离程度小
D. 从b点到d点,溶液中![]() 保持不变(HR代表HClO或HF)
保持不变(HR代表HClO或HF)
查看答案和解析>>
科目: 来源: 题型:
【题目】硫酸亚铁铵又称莫尔盐,是浅绿色晶体.它在空气中比一般亚铁盐稳定,是常用的Fe2+试剂.某实验小组利用工业废铁屑制取莫尔盐,并测定其纯度.
已知:①
| 10 | 20 | 30 | 40 | 50 | 70 |
(NH4)2SO4 | 73.3 | 75.4 | 78.0 | 81.0 | 84.5 | 91.9 |
FeSO47H2O | 40.0 | 48.0 | 60.0 | 73.3 | ﹣ | ﹣ |
(NH4)2SO4FeSO46H2O | 18.1 | 21.2 | 24.5 | 27.9 | 31.3 | 38.5 |
②莫尔盐在乙醇溶剂中难溶.
Ⅰ.莫尔盐的制取

试分析:
(1)必须在铁屑少量剩余时进行过滤,其原因是______________________.
(2)步骤3中包含的实验操作名称_____________________.
(3)产品莫尔盐最后用______________________ 洗涤(填字母编号).
a.蒸馏水 b.乙醇 c.滤液
Ⅱ.为测定硫酸亚铁铵(NH4)2SO4FeSO46H2O晶体纯度,某学生取m g硫酸亚铁铵样品配制成500mL溶液。根据物质组成甲、乙、丙三位同学设计了如下三个实验方案,请回答:
方案一:取20.00mL硫酸亚铁铵溶液用0.1000molL﹣1的酸性KMnO4溶液分三次进行滴定.
方案二:取20.00mL硫酸亚铁铵溶液进行如下实验.
![]()
(4)若实验操作都正确,但方案一的测定结果总是小于方案二,其可能原因为_________,验证推测的方法为:___________________________________________方案三:(通过NH4+测定)实验设计图如下所示.取20.00mL硫酸亚铁铵溶液进行该实验.

(5)装置___________ (填“甲”或“乙”)较为合理,判断理由是_______________.
(6)量气管中最佳试剂是__________ (填字母编号.如选“乙”则填此空,如选“甲”此空可不填).
a.水 b.饱和NaHCO3溶液 c.CCl4
(7)若测得NH3的体积为V L(已折算为标准状况下),则该硫酸亚铁铵晶体的纯度为_______.
查看答案和解析>>
科目: 来源: 题型:
【题目】化合物(G)的合成路线如下:

已知:CH3(CH2)4Br![]() CH3(CH2)3CH2MgBr
CH3(CH2)3CH2MgBr
(1)G中所含的含氧官能团有________、__________(写官能团名称)。可以用________
仪器检测G中的官能团。
(2)A→B的过程中需加入K2CO3粉末,其主要作用是____________________。
(3)C→D的反应类型是______;在空气中久置,A可由白色转变为橙黄色,其原因是______。
(4)写出符合下列条件的A的一种同分异构体的结构简式:__________(只写一种)。
①能发生银镜反应,与FeCl3溶液能发生显色反应;
②除苯环外,含有3种不同的官能团;
③该分子核磁共振氢谱有5种不同的峰,且峰值比为1∶1∶2∶2∶2。
(5)写出以苯、乙醇为原料制备苯丙酮(![]() )的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:H2C=CH2
)的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:H2C=CH2![]() CH3CH2Br
CH3CH2Br![]() CH3CH2OH______。
CH3CH2OH______。
查看答案和解析>>
科目: 来源: 题型:
【题目】某银白色金属单质A在空气中加热燃烧时发出黄色火焰,得到淡黄色固体B,A暴露在空气中足够长时间变为C,B和酸性气体D能生成C,A和B都能与水生成E,E和D也能生成C。回答下列问题。
(1)写出下列物质的化学式:C_____________,D_____________,E_____________。
(2)写出下列反应的化学方程式:
①A和水生成E:______________________________________________________;
②B和D生成C:______________________________________________________;
③A在空气中加热:___________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验方案能达到相应实验目的的是
A.用浓硫酸干燥NH3B.用Cu与稀硝酸反应制取少量NO
C.用KMnO4酸性溶液鉴别SO2与CH2=CH2D.用铜粉除去CuCl2溶液中少量FeCl3
查看答案和解析>>
科目: 来源: 题型:
【题目】根据反应Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O,回答下列问题:
CuSO4+SO2↑+2H2O,回答下列问题:
(1)用“双线桥法”标出电子转移的方向和数目________________。
(2)请用化学式写出该反应中的还原剂是__________;氧化剂是__________;氧化产物是__________。
(3)还原剂和还原产物物质的量之比__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com