
科目: 来源: 题型:
【题目】(1)写出NaHSO4在水中的电离方程式_____。
(2)粗盐中含可溶性CaCl2、MgCl2及一些硫酸盐,要除去这些杂质,可选用以下试剂:①Na2CO3、②NaOH、③BaCl2,则试剂加入的先后顺序是_____(填序号)。
(3)实验证明铜不能在低温下与O2反应,也不能与稀H2SO4共热发生反应,但工业上却是将废铜屑倒入热的稀H2SO4中并通入空气来制备CuSO4溶液的,则铜屑在此状态下被溶解的化学方程式为___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】单质碘在水中的溶解度较小,且溶解较慢。实验室配制碘水时,往往将碘单质加入稀KI溶液中。该溶液中存在平衡: ![]() 。该反应的平衡常数K随温度变化规律如图所示。下列说法中,正确的是
。该反应的平衡常数K随温度变化规律如图所示。下列说法中,正确的是

A. 向上述体系中加入CCl4,平衡不移动
B. 25 C时,向上述体系中加入少量I2,平衡向右移动,平衡常数大于680
C. 该反应的平衡常数表达式为
D. 该反应的正反应为放热反应
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关能量的说法不正确的是( )
A.化石能源物质内部贮存着大量的能量
B.植物的光合作用使太阳能转化为化学能
C.燃料燃烧时只能将化学能转化为热能
D.电能是常用的二次能源
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)现有下列十种物质:① H2O、② 空气、③ Mg、④ H2SO4、⑤ CaO、⑥ CuSO4、⑦ 碘酒、⑧ Ca(OH)2、⑨ 酒精、⑩ NaHCO3,其中属于混合物的是_____(填序号,下同),属于氧化物的是_________,属于酸的是_____,属于碱的是_________,属于盐的是_____。
(2)用化学用语填空:
氯原子的结构示意图_____;Na2O2中氧元素的化合价为_____;5个磷酸根离子_____;
(3)NH4+的摩尔质量为_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】电池的“理论比能量”指单位质量的电极材料理论上能释放的最大电能。“金属(M)空气电池”(如下图)具有原料易得、能量密度高等优点。该类电池放电的总反应方程式为:4M+nO2+2nH2O=4M(OH) n。下列说法不正确的是
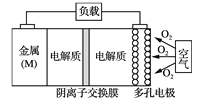
A. “金属(M)空气电池”放电过程的正极反应式: O2+2H2O+4e-=4OH-
B. 比较Mg、Al、Zn三种“金属—空气电池”,“Al—空气电池”的理论比能量最高
C. 电解质溶液中的阴离子从负极区移向正极区
D. 在“M—空气电池”中,为防止负极区沉积Mg(OH)2,宜采用中性电解质及阳离子交换膜
查看答案和解析>>
科目: 来源: 题型:
【题目】氮元素能够形成多种化合物。请回答下列问题:
(1)联氨(N2H4)常温下为液态,在空气中迅速完全燃烧生成N2,同时大量放热,可作导弹、宇宙飞船、火箭的燃料。
已知:H2(g)+1/2O2(g) = H2O(l) △H1= —285.8kJ/mol
N2(g)+2H2(g) = N2H4(l) △H2= + 50.6kJ/mol
则N2H4(l)在空气燃烧生成液态水的热化学方程式为_______________________。
(2)利用氨气生产氢氰酸(HCN)的反应CH4(g)+NH3(g)=HCN(g)+3H2(g)△H>0
①一定温度下,向2L恒容容器中充入1molCH4(g)和2molNH3(g)发生上述反应,4min达到平衡时,测得CH4平衡转化率为66.67%,0~4min内,用H2表示的该反应速率v(H2)=___________。保持温度和容积不变,再向平衡后的容器中充入2molNH3和2molH2,此时v正 ___v逆(选填“>”“<”或“=”)。
②平衡体系中HCN的物质的量(n)随某物理量变化曲线如图所示(图中x、L分别表示温度或压强)。
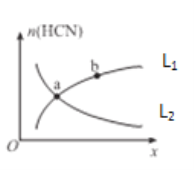
若x为温度,则曲线,____(选填“L1”或“L2”)能正确表示n(HCN)与温度的关系;
若x为压强,则曲线____(选填“L1”或“L2”)能正确表示n(HCN)与压强的关系。
(3)NH3能够形成Ag(NH3)2+。
已知溶液中存在Ag+(aq)+2NH3(aq)==Ag(NH3)2+(aq),常温下该反应平衡常数K1=1.10×107,反应AgCl(s)+2NH3(aq) ![]() Ag(NH3)2+(aq) +Cl-(aq)的化学平衡常数K2=1.936×10-3,则Ksp(AgCl)=____________。
Ag(NH3)2+(aq) +Cl-(aq)的化学平衡常数K2=1.936×10-3,则Ksp(AgCl)=____________。
(4)硫氧化物和氮氧化物是常见的大气污染物,利用如图所示装置(电极均为惰性电极)可吸收SO2,并用阴极排出的溶液吸收NO2。
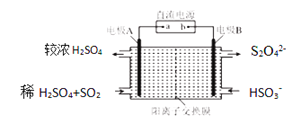
①电极A的电极反应式为__________________________________。
②在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时有SO32-生成。该反应离子方程式为________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】重金属元素铬的毒性较大,含铬废水需经处理达标后才能排放。
Ⅰ.某工业废水中主要含有Cr3+,同时还含有少量的Fe2+、Fe3+、Al3+、Ca2+和Mg2+等,且酸性较强。为回收利用,通常采用如下流程处理:
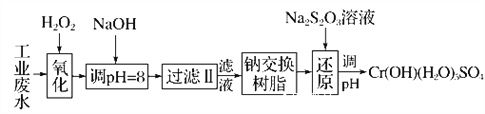
注:常温下,部分阳离子以氢氧化物形式完全沉淀时所需的pH,如下表:
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
pH | 3.7 | 9.6 | 11.1 | 8 | 9 |
(1)氧化过程中可代替H2O2加入的试剂是________(填字母,下同)。
A.Na2O2 B.HNO3 C.FeCl3 D.KMnO4
(2)加入NaOH溶液调整溶液pH=8时,除去的离子是________;
已知钠离子交换树脂的原理:Mn++nNaR―→MRn+nNa+,此步操作被交换除去的杂质离子是____________。
A.Fe3+ B.Al3+ C.Ca2+ D.Mg2+
(3)还原过程在酸性条件下进行,每消耗0.8 mol Cr2O![]() 转移4.8 mol e-,该反应离子方程式为________________________________________________________________________。
转移4.8 mol e-,该反应离子方程式为________________________________________________________________________。
Ⅱ.酸性条件下,六价铬主要以Cr2O![]() 形式存在,工业上常用电解法处理含Cr2O
形式存在,工业上常用电解法处理含Cr2O![]() 的废水,该法用Fe作电极电解含Cr2O
的废水,该法用Fe作电极电解含Cr2O![]() 的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3溶液。
的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3溶液。
(1)电解时能否用Cu电极来代替Fe电极?________(填“能”或“不能”),理由是_____________。
(2)常温下,Cr(OH)3的溶度积Ksp=1×10-20,假设溶液的c(Cr3+)=0.01mol/L,当pH应为______时开始生成沉淀。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各图示与对应的描述相符合的是

A. 图甲表示分别稀释pH=11的NaOH溶液和氨水时溶液pH的变化,图中b>a=100
B. 图乙表示某化学平衡的移动,在t1时改变的条件一定是加入催化剂
C. 图丙表示平衡2NO2(g)![]() N2O4(g)在t1时迅速将体积缩小后c(N2O4)的变化
N2O4(g)在t1时迅速将体积缩小后c(N2O4)的变化
D. 图丁表示CH3COOH溶液中通入NH3至过量的过程中溶液导电性的变化
查看答案和解析>>
科目: 来源: 题型:
【题目】已知草酸为二元弱酸:
H2C2O4![]() HC2O4-+H+ Ka1
HC2O4-+H+ Ka1
HC2O4-![]() C2O42-+H+ Ka2
C2O42-+H+ Ka2
常温下,向某浓度的草酸溶液中逐滴加入一定量浓度的KOH溶液,所得溶液中H2C2O4、HC2O4-、C2O42-三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,则下列说法中不正确的是

A.pH=1.2溶液中:c(K+) + c(H+) = c(OH-) + c(H2C2O4)
B.pH=2.7溶液中:c2(HC2O4-) / [c(H2C2O4) × c(C2O42-)]=1000
C.将相同物质的量KHC2O4和K2C2O4固体完全溶于水可配得pH为4.2的混合液
D.向pH=1.2的溶液中加KOH溶液将pH增大至4.2的过程中水的电离度一直增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com