
科目: 来源: 题型:
【题目】下列说法正确的是
A. 用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热,熔化后的液态铝滴落下来说明金属铝的熔点较低
B. 用如图装置进行实验,将装置①中的AlCl3滴入装置②浓氢氧化钠,溶液中可观察到有大量白色沉淀产生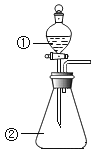
C. Na2O2在空气中久置变白,涉及的氧化还原反应中,Na2O2是还原剂H2O是氧化剂
D. 向明矾溶液里滴加Ba(OH)2溶液,当SO42-恰好完全沉淀时,铝元素几乎全部以AlO2—形式存在于溶液中
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数值。下列有关叙述正确的是
A. 5.6 g Fe在氧气中燃烧,完全反应时转移电子数为0.3NA
B. 标准状况下,22.4 L氦气与22.4 L氯气所含原子数均为2 NA
C. 32 gCu与S完全反应转移的电子数为0.5NA
D. 1mol O2与足量Na反应,生成Na2O和Na2O2的混合物转移的电子数为2NA
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D、E是原子序数依次增大的五种短周期主族元素,其中A的原子序数是B和D原子序数之和的1/4,C元素的最高价氧化物的水化物是一种中强碱,甲和丙是D元素的两种常见氧化物,乙和丁是B元素的两种常见同素异形体,0.005mol/L戊溶液的pH=2,它们之间的转化关系如图所示(部分反应物省略),下列叙述正确的是( )
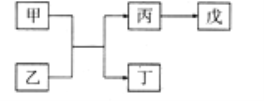
A. C、D两元素形成化合物属共价化合物
B. C、D的简单离子均能促进水的电离
C. A、D分别与B元素形成的化合物都是大气污染物
D. E的氧化物水化物的酸性大于D的氧化物水化物的酸性
查看答案和解析>>
科目: 来源: 题型:
【题目】通过膜电池可除去废水中的乙酸钠和对氯笨酚(![]() ),其原理如下图所示,下列说法正确的是
),其原理如下图所示,下列说法正确的是

A. B为电池的正极,发生还原反应
B. 电流方向从B极沿导线经小灯泡流向A极
C. A极的电极反应式为:![]()
D. 当外电路中有0.2mole-转移时,A极区增加的H+的数目为0.1NA
查看答案和解析>>
科目: 来源: 题型:
【题目】联氨(N2H4)是一种无色的可燃液体。请回答下列问题:
(1)联氨是火箭的重要燃料。已知:
(a) N2H4(l)的燃烧热ΔH1 = –624.0 kJmol–1
(b) ![]() ΔH2 = –66.4 kJmol–1
ΔH2 = –66.4 kJmol–1
(c) ![]() ΔH3 = –28.6 kJmol–1
ΔH3 = –28.6 kJmol–1
写出N2H4(l)在N2O4(g)中燃烧生成氮气和液态水的热化学方程式________________。
(2)N2H4能使锅炉内壁的铁锈(主要成分为Fe2O3xH2O)变成磁性氧化铁,从而可减缓锅炉锈蚀。反应过程中每生成0.1 mol磁性氧化铁,转移的电子数为_________________。
(3)联氨-空气燃料电池的电解质为KOH溶液。写出该电池放电时负极的反应式________。
(4)联氨的制备方法有多种,尿素法是其中之一。在KMnO4的催化作用下,尿素CO(NH2)2和NaClO、NaOH溶液反应生成联氨、水和两种钠盐,写出该反应的化学方程式_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)我国首创以铝_空气_海水电池作为能源的新型的海水标志灯,以海水为电解质溶液,靠空气中的氧气使铝不断氧化而产生电流,只要把灯放入海水数分钟,就会发出耀眼的白光。则电源的负极材料是________,负极反应为_____________;正极材料是__________,正极反应为_______________。
(2)熔盐电池具有高的发电效率,因而受到重视, 可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为阳极燃气,空气与CO2的混合气为阴极助燃气,制得在650 ℃下工作的燃料电池,完成有关电池反应式。阳极反应式:2CO+2CO![]() -4e-===4CO2,阴极反应式:____________,电池总反应式:____________ 。
-4e-===4CO2,阴极反应式:____________,电池总反应式:____________ 。
(3)离子液体是一种室温熔融盐,为非水体系,由有机阳离子、Al2Cl7—和AlCl4—组成的离子液体作电解液时,可在钢制品上电镀铝。钢制品应接电源的________极,已知电镀过程中不产生其他离子且有机阳离子不参与电极反应,阴极电极反应式为_______________。若改用AlCl3水溶液作电解液,则阴极产物为_________。
(4) “镁-次氯酸盐”燃料电池的装置如图所示,该电池的正极反应式为_________________。
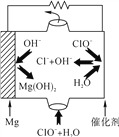
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,在三个等体积的恒容密闭容器中,反应2CO2(g)+6H2(g) ![]() C2H5OH(g)+3H2O(g)达平衡,下列说法正确的是
C2H5OH(g)+3H2O(g)达平衡,下列说法正确的是
容器 | 温度/K | 物质的起始浓度(mol/L) | 物质的平衡浓度(mol/L) | |||
CO2(g) | H2(g) | C2H5OH(g) | H2O(g) | C2H5OH(g) | ||
甲 | 500 | 0.20 | 0.60 | 0 | 0 | 0.083 |
乙 | 500 | 0.40 | 1.20 | 0 | 0 | |
丙 | 600 | 0 | 0 | 0.10 | 0.30 | 0.039 |
A. 该反应正反应为吸热反应
B. 达平衡时,容器甲中的逆反应速率比容器乙中的小
C. 达平衡时,转化率:α(CO2 ,甲)+α(C2H5OH ,丙)>1
D. 达平衡时,甲、乙容器内:2c(CO2 ,甲)<c(CO2 ,乙)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com