
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列有关叙述不正确的是
A. 乙烯和环丁烷(C4H8)的混合气体共28 g充分燃烧消耗3NA个O2
B. 0.1mol-NH2 (氨基)中所含有的电子数为NA
C. 1L0.1mol·L-1Na2S溶液中,S2-、HS-和H2S的微粒数之和为0.1NA
D. 在K37ClO3+ 6H35Cl(浓)=KCl+3Cl2↑+3H2O反应中,若有212 g氯气生成,则反应中电子转移的数目为5NA
查看答案和解析>>
科目: 来源: 题型:
【题目】十九大报告提出要“打赢蓝天保卫战”,意味对环境污染防治比过去要求更高。
(1)烟气中的氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g) H < 0 平衡常数K1
NaNO3(s)+ClNO(g) H < 0 平衡常数K1
2NO(g)+Cl2(g)![]() 2ClNO(g) H < 0 平衡常数K2
2ClNO(g) H < 0 平衡常数K2
4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=__________(用K1、K2表示)。
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=__________(用K1、K2表示)。
(2)利用CO可将NO转化为无害的N2,其反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g)。
N2(g)+2CO2(g)。
在容积均为1 L的甲、乙、丙三个恒温(反应温度分别为300℃、T℃、300℃)容器中分别加入物质的量之比为1:1的NO和CO,测得各容器中n(CO)随反应时间t的变化情况如下表所示:
t/min n(CO) /mol | 0 | 40 | 80 | 120 | 160 |
甲 | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
乙 | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
丙 | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
① 甲容器中,0~40min内用NO的浓度变化表示的平均反应速率v(NO)=_______。
② T ___ 300℃,该反应的△H______0(填“>”或“<”)。
③ 甲容器达平衡时α(NO)=_______。
丙容器达平衡时c(NO)可能为________0.4mol/L(填“>”、“=”或“<”)。
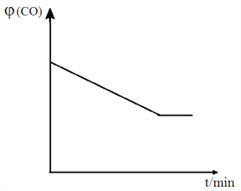
④ 已知甲容器CO的体积分数![]() (CO)随时间t的变化如图,画出其他条件不变,绝热条件下,
(CO)随时间t的变化如图,画出其他条件不变,绝热条件下, ![]() (CO)随时间t的变化示意图。_____________________
(CO)随时间t的变化示意图。_____________________
(3)处理含镉废水常用化学沉淀法。以下是几种镉的难溶化合物25℃时的溶度积常数: Ksp(CdCO3)=5.2×10-12 Ksp(CdS)=3.6×10-29 Ksp(Cd(OH)2)=2.0×10-16,
回答下列问题:
若采用生石灰处理含镉废水最佳pH为11,此时溶液中c(Cd2+)=_________。沉淀Cd2+效果最佳的试剂是____________
a.Na2CO3 b.Na2S c.CaO
查看答案和解析>>
科目: 来源: 题型:
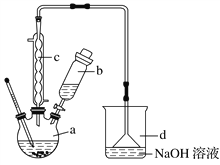
【题目】溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
苯 | 溴 | 溴苯 | |
密度/g·cm-3 | 0.88 | 3.10 | 1.50 |
沸点/℃ | 80 | 59 | 156 |
水中溶解度 | 微溶 | 微溶 | 微溶 |
按下列合成步骤回答问题:
(1)在a中加入15 mL无水苯和少量铁屑。在b中小心加入4.0 mL液态溴。向a中滴入几滴溴,有白色烟雾产生,是因为生成了________气体;继续滴加至液溴滴完;装置d的作用是________________。
(2)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10 mL水,然后过滤除去未反应的铁屑;
②滤液依次用10 mL水、8 mL 10%的NaOH溶液、10 mL水洗涤。NaOH溶液洗涤的作用是_______________________________________________________;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤。加入氯化钙的目的是____________________________________________ 。
(3)经以上分离操作后,粗溴苯中还含有的主要杂质为______,要进一步提纯,下列操作中可行的是________(填字母)。
A.重结晶 B.过滤
C.蒸馏 D.萃取
(4)在该实验中,a的容积最适合的是________(填字母)。
A.25 mL B.50 mL
C.250 mL D.500 mL
查看答案和解析>>
科目: 来源: 题型:
【题目】海水占地球总储水量的97.2%。若把海水淡化和化工生产结合起来,既可以解决淡水资源缺乏的问题,又可以充分利用海洋资源。
(1)目前国际上实用的“海水淡化”主要技术之一是蒸馏法。蒸馏法是将海水变成蒸汽,蒸汽经过冷却而得高纯度淡水,由此可判断蒸馏法是__________(填物理变化、化学变化);
(2)实验室用MnO2和浓盐酸为原料制备氯气,该反应的化学方程式为________________________________,其中氧化剂是_______还原剂是________。尾气处理的离子方程式为______________________________。
(3)工业上制备漂白粉的化学方程式___________________________________。
(4)将实验室制的氯气配成新制的氯水含有多种微粒,试用方程式或化学式回答下列问题:
将氯水滴加紫色石蕊溶液中,先变红后褪色______________________________(化学方程式)其中,变红后褪色是因为有_________(化学式)生成具有漂白性;
将氯水滴入硝酸银溶液中,有白色沉淀生成__________________________。(离子方程式)
查看答案和解析>>
科目: 来源: 题型:
【题目】汉黄芩素是传统中草药黄芩的有效成分之一,对肿瘤细胞的杀伤有独特作用。下列有关汉黄芩素的叙述正确的是( )

A. 汉黄芩素的分子式为C16H13O5
B. 与足量H2发生加成反应后,该分子中官能团的种类减少1种
C. 1 mol该物质与溴水反应,最多消耗1 mol Br2
D. 该物质遇FeCl3溶液显紫色
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于化学反应与能量的说法中,不正确的是( )
A.氢氧化钠与盐酸的反应属于放热反应
B.能量变化是化学反应的基本特征之一
C.原电池是将电能转化为化学能的装置
D.反应物的总能量低于生成物的总能量,反应时从环境吸收能量
查看答案和解析>>
科目: 来源: 题型:
【题目】碘化钠用作甲状腺肿瘤防治剂、祛痰剂和利尿剂等。实验室用NaOH、单质碘和水合肼(N2H4·H2O)为原料可制备碘化钠。
资料显示:水合肼有还原性,能消除水中溶解的氧气;NaIO3是一种氧化剂。
回答下列问题:
(1)水合肼的制备
有关反应原理为:NaClO + 2NH3 = N2H4·H2O + NaCl。
①用下图装置制取水合肼,其连接顺序为_________(按气流方向,用小写字母表示)。
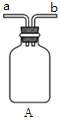
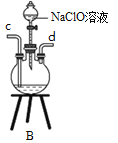
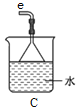
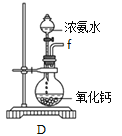
②装置A的作用是_______。
③开始实验时,先向氧化钙中滴加浓氨水,一段时间后再向B的三口烧瓶中滴加NaClO溶液。滴加NaClO溶液时不能过快的理由___________
(2)碘化钠的制备
i. 向三口烧瓶中加入8.4gNaOH及30mL水,搅拌、冷却,加入25.4g碘单质,开动磁力搅拌器,保持60~70℃至反应充分;
ii.继续加入稍过量的N2H4·H2O(水合肼),还原NaIO和NaIO3,得NaI溶液粗品,同时释放一种空气中的气体;
iii.向上述反应液中加入1.0g活性炭,煮沸半小时,然后将溶液与活性炭分离;
iv.将步骤iii分离出的溶液蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得产品24.0g。
④步骤i适宜采用的加热方法是_________, 该步骤反应完全的现象是_________。
步骤ii中IO3-参与反应的离子方程式为________________________________。
⑤步骤iii“将溶液与活性炭分离”的方法是_____________________________。
⑥本次实验产率为__________。实验发现,水合肼实际用量比理论值偏高,可能的原因是________________________________________________。
⑦ 某同学检验产品NaI中是否混有NaIO3杂质。取少量固体样品于试管中,加水溶解,滴加少量淀粉液后再滴加适量稀硫酸,片刻后溶液变蓝。得出NaI中含有NaIO3杂质。请评价该实验结论的合理性___________________________(若认为合理写出离子方程式,若认为不合理说明理由)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列与化学概念有关的说法正确的是( )
A.化合反应均为氧化还原反应
B.金属氧化物均为碱性氧化物
C.烧碱、纯碱、熟石灰都是碱
D.BaSO4、NaOH、HNO3都是强电解质
查看答案和解析>>
科目: 来源: 题型:
【题目】有机物N(![]() )是一种常见的有机合成中间体,在生产中用途广泛。以有机物A为原料合成M和N的路线如下所示:
)是一种常见的有机合成中间体,在生产中用途广泛。以有机物A为原料合成M和N的路线如下所示:
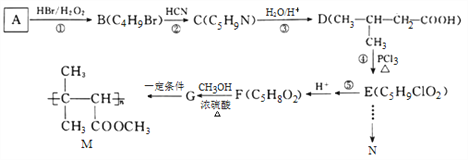
已知:I. ![]()
II. ![]()
请回答下列问题:
(1)A分子中共面的原子数最多为________个,-CN的电子式为_______________。
(2)②的反应类型为________________, E分子中所含官能团的名称为____________,G的结构简式为_____________________。
(3)写出反应⑤的化学方程式__________________________________________,写出M在酸性条件下水解的化学方程式_________________________________。
(4)D的同分异构体中,能发生银镜反应,且能与钠反应放出H2的共有______种,写出核磁共振氢谱有4组峰,且峰面积比为1:1:2:6的一种同分异构体的结构简式:____________________。
(5)结合信息,写出用E和乙醇为原料制备化合物N的合成路线:(其他试剂任选)_____________
![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.镓(Ga)位于周期表的第四周期,与Al同主族,主要存在Ga3+、GaO2-两种离子形式,被广泛应用于电子工业。
(1)用铝粉和Fe2O3做铝热反应实验,需要的试剂还有__________________。
a.KClO3 b. KCl c. MnO2 d. Mg
(2)半导体材料氮化镓由Ga与NH3在一定条件下发生置换反应生成。该过程每生成1molGaN(s)放出热量15.4kJ。镓在周期表中的序号_____________,写出该反应的热化学方程式_________________。
(3)工业上用电解法精炼镓。具体原理如图所示,已知:金属的活动性Zn>Ga>Fe>Cu

①电解精炼镓一段时间后形成的阳极泥主要有______________
②已知精炼时阴极反应:GaO2-+3e-+2H2O=Ga+4OH- 。阳极的电极反应方程式:___________________________________;
Ⅱ.用废铁皮制取铁红(Fe2O3)的部分流程示意图如下:

(4)步骤I温度不能过高。因为:_______________________________。
(5)步骤II中发生反应4Fe(NO3)2+O2+(2n+4)H2O=2Fe2O3·nH2O+8HNO3,生成的硝酸又将废铁皮中的铁转化为Fe(NO3)2。
写出后者反应的离子方程式______________________________________。
(6)上述生产流程中,能体现“绿色化学”思想的是______________________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com