
科目: 来源: 题型:
【题目】黄血盐[亚铁氰化钾,K4Fe(CN)6]目前广泛用做食盐添加剂(抗结剂),制备黄血盐的一种工艺如下:

回答下列问题:
(1)实验室用绿矾晶体配制硫酸亚铁溶液时,为了防止其变质需要添加的试剂为__________________。
(2)步骤Ⅱ中滤渣的主要成分是_______________,步骤Ⅴ所用的试剂X可以是________________。
(3)步骤Ⅲ反应的化学方程式为_______________________________________。
(4)工艺中用到剧毒的HCN溶液,含CN-的废水必须处理后才能排放。25℃时,Ka(HCN) =6.25×10-10。
①HCN的电子式为__________________。
②25℃时,反应CN-+H2O![]() HCN+OH-的平衡常数K=_____________________。
HCN+OH-的平衡常数K=_____________________。
③含CN-废水的处理方法之一是:pH控制在11左右,用氯气将废水中CN-氧化成CO2和N2,该反应的离子方程式为_____________________________________。
(5)近日,一条“盐里面加进了亚铁氰化钾”危害身体健康的信息在网上流传。已知K4Fe(CN)6![]() 4KCN+FeC2+N2↑,氰化钾的半数致死量(LD50)为6.4 mg·kg-1 (即每1kg体重6.4 mg),我国卫生部规定食盐中黄血盐的最大使用量为10 mg·kg-1。假设烹饪过程中黄血盐发生上述分解,一名60Kg男子每天摄入60g食盐是否达到氰化钾的半数致死量?_________________________________。(列式计算说明)。
4KCN+FeC2+N2↑,氰化钾的半数致死量(LD50)为6.4 mg·kg-1 (即每1kg体重6.4 mg),我国卫生部规定食盐中黄血盐的最大使用量为10 mg·kg-1。假设烹饪过程中黄血盐发生上述分解,一名60Kg男子每天摄入60g食盐是否达到氰化钾的半数致死量?_________________________________。(列式计算说明)。
查看答案和解析>>
科目: 来源: 题型:
【题目】向100 mL氢氧化钠溶液中通入一定量的二氧化碳气体充分反应后,再向所得溶液中逐滴加入0.2 mol/L的盐酸,产生二氧化碳的体积(标准状况下)与所加盐酸体积之间的关系如图所示:

据图回答下列问题:
(1)原NaOH溶液的浓度为____________;
(2)标准状况下,通入CO2体积是____________;
(3)所得溶液中溶质的成分和物质的量之比为_______________________(溶质成分用化学式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】三氯氧磷(POCl3)可用作有机合成的氯化剂和催化剂。
已知:①KSCN+AgNO3=AgSCN↓+KNO3;
②Ksp(AgCl) > Ksp(AgSCN);
③磷酸银可溶于硝酸;
④PCl3和POCl3的相关信息如下表:
物质 | 熔点/℃ | 沸点/℃ | 相对分子质量 | 性质 |
PCl3 | -111.8 | 74.2 | 137.5 | 均为无色液体,遇水均剧烈水解,生成含氧酸和氯化氢,两者互溶。 |
POCl3 | 2.0 | 105.3 | 153.5 |
实验室制取POCl3并测定产品纯度的实验过程如下:
Ⅰ.制备POCl3可用氧气氧化液态PCl3的方法。实验装置(加热及夹持装置省略)如下:
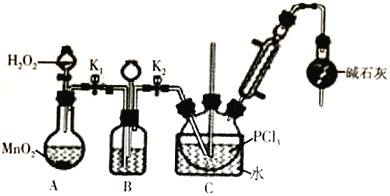
(1)装置C中盛装PCl3的仪器名称为_______________________;氧气氧化PCl3的化学方程式为_______________________________。
(2)仪器组装完成后,检查装置B气密性的方法是_______________________________。
(3)装置B的作用有________________________________(回答两点)。
(4)装置C的反应温度控制在60-65℃之间,原因是____________________________________。
Ⅱ.测定产品中POCl3纯度的实验步骤:
①实验Ⅰ结束后,待反应器中液体冷却到室温,准确称取1.3300 g的POCl3粗产品(杂质不含氯元素),置于盛有50.00mL蒸馏水的烧杯中摇动至完全水解,将水解液配成100.00mL溶液;
②取10.00mL溶液于锥形瓶中,加入30.00mL0.1200mol·L-1AgNO3标准溶液;
③加入少量硝基苯,用力摇动,静置;
④加入指示剂,用0.1000 mol·L-1KSCN溶液滴定过量的AgNO3溶液,到达终点时共用去12.00mLKSCN溶液。
(5)滴定过程中选择的指示剂为___________溶液。
(6)步骤③的目的是___________________________________________________。
(7)测得产品中POCl3的纯度为__________%。
查看答案和解析>>
科目: 来源: 题型:
【题目】氰[(CN)2]的化学性质与卤素(X2)很相似,化学上称之为拟卤素,其氧化性介于Br2和I2之间,下列有关反应方程式不正确的是
A. (CN)2和NaOH溶液反应:(CN)2+2OH-=CN-+CNO-+H2O
B. MnO2和HCN反应:MnO2+4HCN(浓)![]() Mn(CN)2+(CN)2↑+2H2O
Mn(CN)2+(CN)2↑+2H2O
C. 向KCN溶液中加入碘水:I2+2KCN=2KI+(CN)2
D. 在NaBr和KCN混合溶液中通入少量Cl2:Cl2+2CN-=2Cl-+(CN)2
查看答案和解析>>
科目: 来源: 题型:
【题目】铀是原子反应堆的原料,常见铀的化合物有UF4、UO2、及(NH4)4[UO2(CO3)3]等,回答下列问题:
(1)基态氟原子的价电子排布图为________________;用Mg或Ca还原UF4可得金属铀,其氧化产物MgF2的熔点高于CaF2,原因是_______________________________;
(2)已知:2UO2+5NH4HF2![]() 2UF4·2NH4F+3NH3↑+4H2O↑
2UF4·2NH4F+3NH3↑+4H2O↑
①NH4HF2中存在的微粒间的作用力是__________(填选项字母)。
A.离子键 B.配位键 C.共价键 D.范德华力
②该反应中非金属元素的第一电离能由大到小的顺序是__________(填元素符号)。
(3)已知:3(NH4)4[UO2(CO3)3] ![]() 3UO2+10NH3↑+9CO2↑+ N2↑+ 9H2O↑
3UO2+10NH3↑+9CO2↑+ N2↑+ 9H2O↑
①分解产物中属于非极性分子的是_________(填选项字母)。
A.NH3 B.CO2 C.N2 D.H2O
②反应物中的CO32-的空间构型为_____________。分子中的大![]() 键可用符号
键可用符号![]() 表示,其中m代表参与形成大
表示,其中m代表参与形成大![]() 键的原子数,n代表参与形成大
键的原子数,n代表参与形成大![]() 键的电子数(如苯分子中的大
键的电子数(如苯分子中的大![]() 键可表示为
键可表示为![]() ),则CO32-中的大
),则CO32-中的大![]() 键应表示为______________。
键应表示为______________。
③HN3(氢叠氮酸)常用于引爆剂,其分子的结构式可表示为:![]() 。则左边氮原子和中间氮原子的杂化方式分别为______________、_______________。
。则左边氮原子和中间氮原子的杂化方式分别为______________、_______________。
(4)UO2的晶胞结构如图所示:
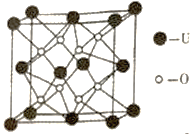
①晶胞中铀原子位于面心和顶点,氧原子填充在铀原子堆积形成的空隙中。则氧原子填充在铀原子形成的___________空隙中。(填“立方体”、“四面体”、“八面体”)
②若两个氧原子间的最短距离为a nm,则UO2晶体的密度为___________g·cm-3(列出计算式即可,设NA表示阿伏加德罗常数的值)。
查看答案和解析>>
科目: 来源: 题型:
【题目】关于下列四个图象的说法中不正确的是
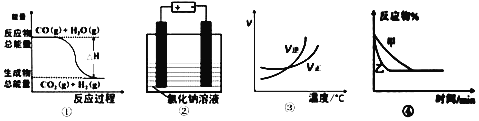
A. 图①可表示可逆反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH<0
CO2(g)+H2(g) ΔH<0
B. 图②表示用惰性电极电解足量氯化钠溶液时,两极产生的气体物质的量相等
C. 图③可表示可逆反应:A2(g)+3B2(g)![]() 2AB3(g) ΔH >0
2AB3(g) ΔH >0
D. 图④可表示压强对可逆反应:2A(g)+B(g)![]() 3C(g)+D(s)的影响,且乙压强大
3C(g)+D(s)的影响,且乙压强大
查看答案和解析>>
科目: 来源: 题型:
【题目】对于恒定容积的密闭容器中进行的反应A(s)+B(g)![]() 2C(g) ΔH<0,平衡后只改变下列条件,有关叙述正确的是
2C(g) ΔH<0,平衡后只改变下列条件,有关叙述正确的是
A. 加入少量A物质,平衡正向移动,正反应速率加快
B. 加入少量B物质,平衡正向移动,逆反应速率减小
C. 充入氩气(不参加反应),平衡逆向移动,逆反应速率加快
D. 升高温度,平衡逆向移动,正反应速率和逆反应速率都加快
查看答案和解析>>
科目: 来源: 题型:
【题目】金属镍有广泛的用途.粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是
(已知:氧化性Fe2+<Ni2+<Cu2+)
A. 阳极发生还原反应,其电极反应式:Ni2++2e-===Ni
B. 电解过程中,阳极质量的减少与阴极质量的增加相等
C. 电解后,溶液中存在的金属阳离子只有Fe2+和Zn2+
D. 电解后,电解槽底部的阳极泥中只有Cu和Pt
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示,A处通入潮湿的Cl2,关闭B阀时,C处干燥的红色布条看不到明显现象,打开B阀后,C处红色布条逐渐褪色,则D瓶中装的不可能是( )

A. 浓H2SO4 B. NaOH溶液 C. 澄清石灰水 D. 饱和NaCl溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com