
科目: 来源: 题型:
【题目】某同学设计如图所示装置,探究氯碱工业原理,下列说法正确的是

A. 石墨电极与直流电源负极相连
B. 铜电极的反应式为:2H2O+2e-![]() 2OH-+H2↑
2OH-+H2↑
C. 氢氧化钠在石墨电极附近产生, Na+ 向石墨电极迁移
D. 用湿润KI淀粉试剂在铜电极附近检验气体,试纸变蓝色
查看答案和解析>>
科目: 来源: 题型:
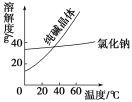
【题目】NaCl样品中含有少量的Na2SO4和Na2CO3,按下列流程进行净化。
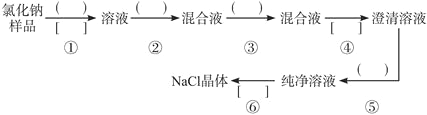
(1)流程第②③步中应分别使用________、_________试剂,第⑥步中应进行_________操作
(2)写出第⑤步发生反应的化学方程式:______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】向0.1mol/L CH3COOH溶液中加入CH3COONa晶体或加水稀释时,都会引起
A. 溶液的pH增大 B. CH3COOH的电离程度增大
C. 溶液的导电能力减小 D. 溶液的c(OH-)减小
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于反应自发性的说法正确的是
A. △H<0、△S>0的反应,有利于自发进行
B. 化合反应都是放热反应,分解反应都是吸热反应
C. 凡是放热反应都是自发的,吸热反应都是非自发的
D. 自发反应在任何条件下都能自动进行,现象明显
查看答案和解析>>
科目: 来源: 题型:
【题目】有机物F是一种临床常用的基本药物,有广泛的用途,其合成路线如下:
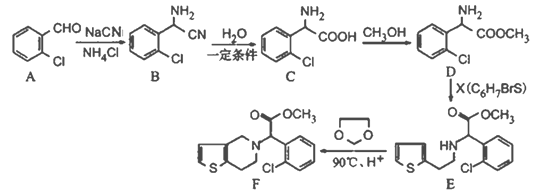
(1)写出B的分子式________________;C中碱性官能团的名称为____________________。
(2)写出与A含有相同官能团,属于芳香族化合物;且含有3种不同化学环境氢原子的同分异构体的结构简式__________________________________。
(3)C→D的反应类型是______________;X的结构简式为______________________。
(4)两个C分子可在一定条件下反应生成一种产物,该产物分子中含有3个六元环,写出该反应的化学方程式____________________________________。
(5)已知: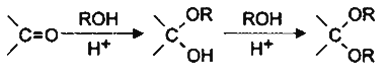
I.则由乙醇、甲醇为有机原料制备化合 物,不需要经历下列的反应类型有____(填写编号)。
物,不需要经历下列的反应类型有____(填写编号)。
①加成反应,②消去反应,③取代反应,④氧化反应,⑤还原反应。
II.写出制备化合物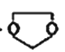 的最后一步反应的化学方程式________________________。
的最后一步反应的化学方程式________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】I.阅读、分析下列两个材料:
材料一
材料二
物质 | 熔点/℃ | 沸点/℃ | 密度/ g/cm3 | 溶解性 |
乙二醇(C2H6O2) | -11.5 | 198 | 1.11 | 易溶于水和乙醇 |
丙三醇(C3H8O3) | 17.9 | 290 | 1.26 | 能跟水、酒精以任意比互溶 |
回答下列问题(填字母序号):
(1)从含少量NaCl的Na2CO3中提纯Na2CO3的操作为溶解、_________、________、过滤、洗涤、干燥
(2)将乙二醇和丙三醇相互分离的最佳方法是_________。
A.蒸馏法 B.萃取法 C.结晶法 D.分液法
II.青蒿素是最好的抵抗疟疾的药物,可从黄花蒿茎叶中提取,它是无色针状晶体,可溶于乙醇、乙醚等有机溶剂,难溶于水。常见的提取方法如下
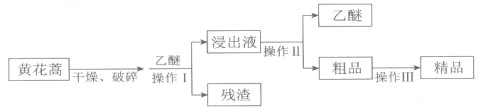
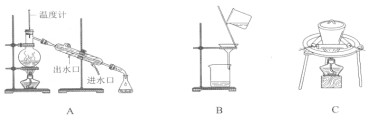
操作I、II中,不会用到的装置是________(填序号)。
Ⅲ.实验室用98%、密度为1.84g/cm3的浓硫酸配制0.2mol/L的H2SO4溶液470mL.
(1)需要使用的主要仪器有量筒、烧杯、玻璃棒、___________、__________。
(2)其操作步骤可分解为以下几步:
A.用量筒量取______mL浓硫酸,缓缓注入装有约50mL蒸馏水的烧杯里,并用玻璃棒搅拌。
B.用适量蒸馏水分三次洗涤烧杯和玻璃棒,将每次的洗液都移入容量瓶里。
C.将稀释后的硫酸小心地用玻璃棒引流容量瓶里。
D.检查容量瓶是否漏水。
E.将蒸馏水直接加入容量瓶,至液面接近刻度线1-2cm处。
F.盖紧瓶塞,反复颠倒振荡,摇匀溶液。
G.用胶头滴管向容量瓶里逐滴加入蒸馏水,到液面最低点恰好与刻线相切。
请据此填写:
①完成上述步骤中的空白处。
②补充完成正确的操作顺序(用字母填写):____________
( D )→( A )→ → → → →( F )。
(3)下列操作会使所配稀硫酸浓度偏高的是______________。
A、取用浓硫酸时仰视刻度线
B、容量瓶用蒸馏水洗涤后用1.2mol/L的硫酸润洗
C、转移溶液时,不慎有少量溶液洒出
D、定容时仰视容量瓶刻度线
E、将稀释后的稀硫酸立即转入容量瓶且进行后面的实验操作
F、定容后,把容量瓶倒置摇匀,正放后发现液面低于刻度线,又补充几滴 蒸馏水至刻度线
查看答案和解析>>
科目: 来源: 题型:
【题目】水溶液中能大量共存的一组离子是( )
A.NH4+、Ba2+、Brˉ、CO32ˉ
B.Clˉ、NO3ˉ、Fe2+、H+
C.K+、Na+、SO42ˉ、MnO4ˉ
D.Na+、H+、SO42ˉ、HCO3ˉ
查看答案和解析>>
科目: 来源: 题型:
【题目】以冶炼金属铝的废弃物铝灰为原料制取超细![]() -氧化铝,既能降低环境污染又可提高铝资源的利用率。已知铝灰的主要成分为A12O3(含少量杂质SiO2、FeO、Fe2O3),其制备流程如下:
-氧化铝,既能降低环境污染又可提高铝资源的利用率。已知铝灰的主要成分为A12O3(含少量杂质SiO2、FeO、Fe2O3),其制备流程如下:
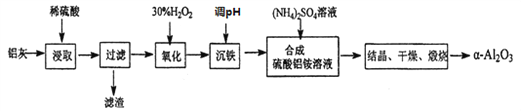
(1)用上图中“滤渣”和NaOH焙烧制备硅酸钠,可采用的装置为____(填选项编号)。

(2)流程中加入H2O2 有气体产生,原因是_______________________________。
(3)通过调节溶液的pH来“沉铁”,得到Fe(OH)3。己知:
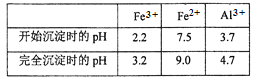
为保证产品的纯度,可以选用下列物质中的_______调节溶液pH(填字母),调节pH的范围为___________________________。
a.A12O3 b.NaOH c.Al(OH) 3 d.Na2CO3
(4)煅烧硫酸铝铵晶体,发生的主要反应为:
4[NH4 Al(SO4)2·12H2O] ![]() 2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O,
2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O,
将产生的气体通过下图所示的装置:
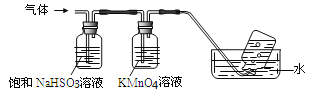
①集气瓶中收集到的气体是_____________________(填化学式);
②装有KMnO4溶液洗气瓶的作用是__________________________________;
③选用一种常用化学试剂和稀硝酸检验硫酸铝铵,该试剂是______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】金刚石、石墨、C60和石墨烯都是碳的同素异形体,其结构示意图如下:
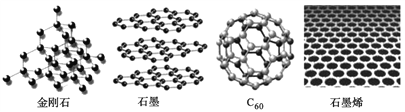
(1)石墨晶体中存在的作用力有________________________________
(2)金刚石质硬但脆,金刚石能被砸碎的原因是___________________________;金刚石、石墨、C60的熔点由高到低的顺序是________________________。
(3)C60晶体的堆积方式为______________;晶体中C60的配位数为_________。
(4)石墨烯具有神奇的特性,两位科学家由于对石墨烯研究做出重大贡献而获得了2010年诺贝尔物理学奖。石墨烯即单层石墨。石墨烯中碳原子的杂化轨道类型为_______________;碳碳键的键角是_________;碳原子和碳碳键的个数比是_______;12g石墨烯中含有________个六元环。
(5)碳化硅的结构与金刚石类似,设碳化硅的密度为a g/cm3,碳化硅晶体内碳硅键的键长为______pm(用NA表示阿伏加德罗常数的值,列表达式即可)。
查看答案和解析>>
科目: 来源: 题型:
【题目】大多数化学反应都存在“能垒”(活化能),下列反应可以认为不存在“能垒”的是
A. 甲烷的燃烧 B. 溶液中的H+与OH-的反应
C. 氢气与氯气化合 D. 铝热反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com