
科目: 来源: 题型:
【题目】25℃,pH=2的两种一元酸HX、HY各取5 mL,分别加水稀释,溶液pH变化与所加水的体积关系如图所示(忽略混合溶液体积的变化),下列说法错误的是
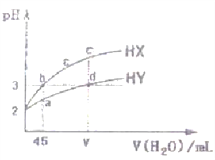
A. 分别取等体积a、b两点溶液,完全中和需同浓度NaOH溶液的体积V(HX)=V(HY)
B. b、d两点溶液中由水电离产生的H+浓度![]()
C. 相同条件下,a、b、c、d、e五点溶液的导电性大小顺序为:a>b=d>c>e
D. 加入NaOH溶液,可以使d点c(Y-)增大、c(H+)减小
查看答案和解析>>
科目: 来源: 题型:
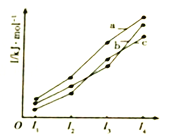
【题目】X、Y、Z、R为前四周期原子序数依次增大的元素。X原子有3个能级,且每个能级上的电子数相等;Z原子的不成对电子数在同周期中最多,且Z的气态氢化物在同主族元素的氢化物中沸点最低;X、Y、R三元素在周期表中同族。
(1)R元素在周期表中的位置是_____________,其基态原子的电子排布式为[Ar]_______。
(2)如图表示X、Y、Z的四级电离能变化趋势,其中表示Z的曲线是_______(填标号)。
(3)化合物(XH2=X=O)分子中X原子杂化轨道类型是____________,1mol(X2H5O)3Z=O分子中含有的σ键与π键的数目比为__________________。
(4)Z与氯气反应可生成一种各原子均满足8电子稳定结构的化合物,其分子的空间构型为_____。
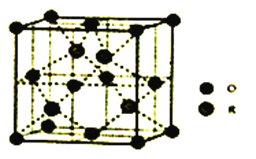
(5)某R的氧化物晶胞结构如图所示。该物质的化学式为_______________。已知该晶体密度为pg·cm-3,距离最近的两个原子的距离为dpm,则R的相对原子质量计算表达式为___________________________(已知lpm=10-12m,阿伏加德罗常数为NA)。
(6)X形成的一种常见单质,性质硬而脆,原因是_______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】氢气、碳氧化物是合成可再生能源甲醇的基础原料,具有重要的应用前景。
(1)已知H2(g)、CO(g)和CH4(g)的燃烧热分别为285.8 kJ·mol-1、283.0 kJ·mol-1和890.0 kJ·mol-1。一定条件下,CO与H2合成甲烷的热化学方程式为:CO(g)+3H2(g)==CH4(g)+H2O(1)△H
则△H=________;该反应能自发进行的原因是_____________________________________。
(2)工业上一般采用下列两种反应合成甲醇:
反应I:CO(g)+2H2(g) ![]() CH3OH(g)
CH3OH(g)
反应II:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
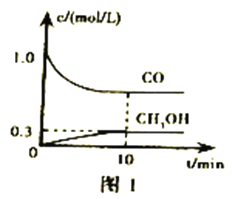
①一定温度下,在体积可变的恒压密闭容器中加入4molH2和一定量的CO发生反应I,开始时容器体积为2L,CO和CH3OH(g)的浓度随时间变化如图1。10min达到平衡,则反应I的化学平衡常数为______________(结果保留一位小数)。
②恒温恒容条件下,在密闭容器中通入等物质的量的CO2和H2,下列描述能说明反应II已经达到平衡状态的是________________(填序号)。
A.容器内CO2的体积分数不再变化 B.当CO2和H2转化率的比值不再变化
C.当水分子中断裂2NA个O-H键,同时氢分子中断裂3NA个H-H键
D.容器内混合气体的平均相对分子质量达到34.5,且保持不变
(3)用KOH作电解质的CO碱性燃料电池(如图2)作电源,用惰性电极电解含CN-废水,将CN-彻底氧化为无害气体,以净化废水。该电池的负极反应式为_____________;若开始时正、负两电极区溶液质量相等,当除去1molCN-时,理论上两电极区溶液的质量差为______g。
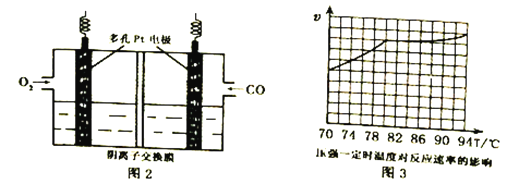
(4)工业上通过CO与甲醇制取甲酸甲酯,热化学方程式为:CO(g)+ CH3OH(g) ![]() HCOOCH3(g)△H =-29kJ·mol-1 。科研人员对该反应进行了研究,部分研究结果如图3。实际工业生产中采用的温度是80℃,其理由是__________________________。
HCOOCH3(g)△H =-29kJ·mol-1 。科研人员对该反应进行了研究,部分研究结果如图3。实际工业生产中采用的温度是80℃,其理由是__________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】雷尼镍(Raney-Ni)是一种多孔结构的镍铝合金,对氢气具有强吸附性,是烯烃、炔烃氢化反应的高效催化剂。一种以铜镍渣(主要含Cu、Fe、Co和Ni)生产雷尼镍的流程如下:
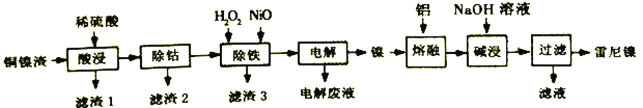
下表列出了有关金属离子生成氢氧化物沉淀的pH:
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
开始沉淀的pH | 1.5 | 6.5 | 7.7 |
沉淀完全的pH | 3.3 | 9.9 | 9.2 |
(1)“酸浸”时,如通入空气并不断搅拌,可将“滤渣1”氧化溶解,离子方程式为___________。
(2)“除铁”时,先加入适量H2O2氧化Fe2+,理论上消耗的n(H2O2):n(Fe2+)=____;再加入NiO以调节溶液的pH。应控制pH的范围为__________________。
(3)“电解”(以惰性材料作电极)是为了获得单质镍。电解产物中可循环利用的物质是_______。
(4)“碱浸”是为了形成多孔结构的雷尼镍,反应的离子方程式为_________________。使用新制雷尼镍进行氢化反应时,不加氢气也可实现氢化的目的,原因是____________________。
(5)“滤液”主要成分与过量CO2反应的离子方程式为__________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】向盛有Cl2的三个集气瓶甲、乙、丙中各注入下列液体中的一种,经过振荡,现象如下图所示,则甲、乙、丙中注入的液体分别是( )

A. ①②③ B. ③②① C. ②①③ D. ①③②
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下水溶液中H+ 和OH- 的浓度变化曲线如图,下列说法正确的是
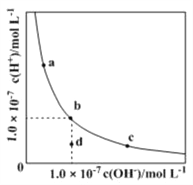
A. 升高温度,可能引起c向b的变化
B. 该温度下,水的离子积常数为![]()
C. 该温度下,加入HCl可能引起由b向a的变化
D. 该温度下,稀释溶液可能引起由c向d的变化
查看答案和解析>>
科目: 来源: 题型:
【题目】NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A. 等物质的量的N2和CO所含分子数均为NA
B. 常温下,0.1molCuSO4·5H2O晶体中氧原子数目为0.4 NA
C. NA个N2分子所占的体积与0.5NA个H2分子所占的体积比为2∶1
D. 常温下,1L 0.1mol·L-1的NH4NO3溶液中氮原子数为0.2NA
查看答案和解析>>
科目: 来源: 题型:
【题目】在0.01mol·L-1 的醋酸溶液中逐渐加入冰醋酸至1mol·L-1,随着浓度的增加,在一定时间内始终保持减小趋势的是
A. c(H+) B. c(CH3COO-)
C. c(H+)/c(CH3COOH)的比值 D. c(CH3COOH)/c(H+)的比值
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com