
科目: 来源: 题型:
【题目】某小组设计不同实验方案比较Cu2+、Ag+ 的氧化性。
(1)方案1:通过置换反应比较
向酸化的AgNO3溶液插入铜丝,析出黑色固体,溶液变蓝。反应的离子方程式是_______,说明氧化性Ag+>Cu2+。
(2)方案2:通过Cu2+、Ag+ 分别与同一物质反应进行比较
实验 | 试剂 | 编号及现象 | |
试管 | 滴管 | ||
| 1.0 mol/L KI溶液 | 1.0 mol/L AgNO3溶液 | Ⅰ.产生黄色沉淀,溶液无色 |
1.0 mol/L CuSO4溶液 | Ⅱ.产生白色沉淀A,溶液变黄 | ||
① 经检验,Ⅰ中溶液不含I2,黄色沉淀是________。
② 经检验,Ⅱ中溶液含I2。推测Cu2+做氧化剂,白色沉淀A是CuI。确认A的实验如下:
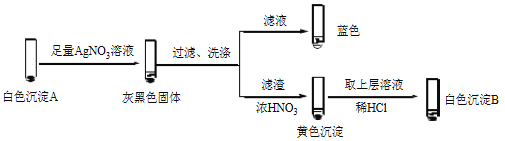
a.检验滤液无I2。溶液呈蓝色说明溶液含有________(填离子符号)。
b.白色沉淀B是________。
c.白色沉淀A与AgNO3溶液反应的离子方程式是____,说明氧化性Ag+>Cu2+。
(3)分析方案2中Ag+ 未能氧化I- ,但Cu2+氧化了I-的原因,设计实验如下:
编号 | 实验1 | 实验2 | 实验3 |
实验 |
|
|
|
现象 | 无明显变化 | a中溶液较快变棕黄色,b中电极 上析出银;电流计指针偏转 | c中溶液较慢变浅黄色; 电流计指针偏转 |
(电极均为石墨,溶液浓度均为 1 mol/L,b、d中溶液pH≈4)
① a中溶液呈棕黄色的原因是_______(用电极反应式表示)。
② “实验3”不能说明Cu2+氧化了I-。依据是空气中的氧气也有氧化作用,设计实验证实了该依据,实验方案及现象是_______。
③ 方案2中,Cu2+能氧化I-,而Ag+未能氧化I-的原因:_______。
(资料:Ag+ + I- = AgI↓ K1 =1.2×1016;2Ag+ + 2I- = 2Ag↓+ I2 K2 = 8.7×108)
查看答案和解析>>
科目: 来源: 题型:
【题目】中国有句古语:“一方水土养一方人”,饮水是提供人体必需的矿物质和微量元素重要途径之一。在天然无污染的泉水中,含有Cu、K、Ca、Zn、P、Mg、Na、Fe等人体必需元素,其中属于大量元素的是
A. Cu、K、Ca、ZnB. K、Ca、P、MgC. P、Cu、Na、FeD. Ca、Zn、P、Mg
查看答案和解析>>
科目: 来源: 题型:
【题目】现有NaCl、FeCl2、FeCl3、MgCl2、AlCl3五种溶液,只用一种试剂就可以鉴别它们,这种试剂是( )
A.盐酸
B.NaOH溶液
C.氨水
D.KSCN溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】SO2广泛用于医药、硫酸工业等领域,回收废气中的SO2可用如下方法。
方法Ⅰ | 用碱式硫酸铝Al2(SO4)x(OH)y溶液吸收富集SO2 |
方法Ⅱ | 在Fe2+或Fe3+催化下,用空气(O2)将SO2氧化为H2SO4 |
(1)方法Ⅰ的过程如下。
① 制备Al2(SO4)x(OH)y
向Al2(SO4)3溶液中加入CaO粉末,调pH至3.6。 CaO的作用之一是促进_______水解(填离子符号,下同),二是沉淀一部分_______。
② 吸收:Al2(SO4)x(OH)y吸收SO2后的产物是_______(写化学式)。
③ 解吸:加热②中产物,产生SO2,Al2(SO4)x(OH)y再生。
(2)方法Ⅱ中,在Fe2+催化下,SO2、O2和H2O生成H2SO4的化学方程式是______。
(3)方法Ⅱ中,Fe2+的催化过程可表示如下:
ⅰ:2 Fe2++ SO2+ O2=2 Fe3++ SO42-
ⅱ: ……
① 写出ⅱ的离子方程式:______。
② 下列实验方案可证实上述催化过程。将实验方案补充完整。
a.向FeCl2溶液滴入KSCN,无变化
b.向FeCl2溶液通入少量SO2,滴入KSCN,颜色变红。
c.取b中溶液,_______。
(4)方法Ⅱ中,催化氧化后,采用滴定法测定废气中残留SO2的含量。将V L(已换算为标准状况)废气中的SO2用1%的H2O2完全吸收,吸收液用下图所示装置滴定,共消耗a mL c mol/L NaOH标准液。

① H2O2氧化SO2的化学方程式_______。
② 废气中残留SO2的体积分数为_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】2017年采用中国自主知识产权的全球首套煤基乙醇工业化项目投产成功。某地用煤制乙醇的过程表示如下。

(1)Cu(NO3)2是制备“催化剂X”的重要试剂。

①气体A是_________。
②实验室中用Cu(NO3)2固体配制溶液,常加入少量稀HNO3。运用化学平衡原理简述HNO3的作用: ________。
③NaClO溶液吸收气体A的离子方程式是_________。
(2)过程a包括以下3个主要反应:
I.CH3COOCH3(g)+2H2(g)![]() C2H5OH(g)+CH3OH(g) △H1
C2H5OH(g)+CH3OH(g) △H1
II.CH3COOCH3(g)+C2H5OH(g)![]() CH3COOC2H5(g)+CH3OH(g) △H2
CH3COOC2H5(g)+CH3OH(g) △H2
III.CH3COOCH3(g)+H2(g)![]() CH3CHO(g)+CH3OH(g) △H3
CH3CHO(g)+CH3OH(g) △H3
相同时间内,测得CH3COOCH3转化率、乙醇和乙酸乙酯的选择性(如乙醇的选择性= ![]() )如下图所示。
)如下图所示。

①已知:△H1<0。随温度降低,反应I化学平衡常数的变化趋势是________。
②下列说法不合理的是_______。
A.温度可影响反应的选择性
B.225℃~235℃,反应I处于平衡状态
C.增大H2的浓度,可以提高CH3COOCH3的转化率
③为防止“反应III”发生,反应温度应控制的范围是____________。
④在185℃,上述反应中CH3COOCH3起始物质的量为5mol,生成乙醇的物质的量是____。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于纯净物、混合物、电解质、非电解质的正确组合为( )
纯净物 | 混合物 | 电解质 | 非电解质 | |
A | 盐酸 | 水煤气 | 硫酸 | 干冰 |
B | 蒸馏水 | 蔗糖溶液 | 氧化铝 | 二氧化硫 |
C | 胆矾 | 盐酸 | 铁 | 碳酸钙 |
D | 胆矾 | 水蒸气 | 氯化铜 | 碳酸钠 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目: 来源: 题型:
【题目】“1998年中国十大科技成果”之一是合成一维纳米氮化镓。已知氮化镓中镓是第ⅢA族元素,则氮化镓的化学式可能为( )
A.GaNB.Ga2N3C.Ga3N2D.GaN2
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法不正确的是( )
A. 化学变化过程是原子的重新组合过程
B. 化学反应的焓变用ΔH表示,单位是kJ·mol-1
C. 化学反应的焓变ΔH越大,表示放热越多
D. 化学反应中的能量变化不都是以热能形式表现出来的
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法中错误的是( )
A. 从1L 1mol·L-1的NaCl溶液中取出10mL,其浓度仍是1mol·L-1
B. 40g NaOH溶于1L的水中所得的溶液中NaOH物质的量浓度是1mol·L-1
C. 0.5L 2mol·L-1 BaCl2溶液中,Ba2+和Cl-总数为3×6.02×1023
D. 制成0.5L 10mol·L-1的盐酸,需要氯化氢气体112L(标准状况)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com