
科目: 来源: 题型:
【题目】有机物M 有抗菌作用,其合成路线如下图所示:

已知:①![]()
②
③
(1)M的分子式是______________,A的化学名称是__________________。
(2)G的结构简式是___________,F中含氧官能团的名称是_______________。
(3)由A生成B和由G生成H 的反应类型分别是___________、____________。
(4)由C生成D 的化学方程式是_________________。
(5)E 的同分异构体中,符合下列条件的结构共有___________种。
①苯的二元取代物 ②与E 具有相同的官能团 ③能发生银镜反应和水解反应
(6)结合题给信息,以甲苯为原料制备化合物![]() ,设计合成路线(其他试剂任选)。 _________
,设计合成路线(其他试剂任选)。 _________
查看答案和解析>>
科目: 来源: 题型:
【题目】铜是人类最早使用的金属之一,金属铜及其化合物在工业生产及生活中用途非常广泛。回答下列问题:
(1)基态+2价铜离子M能层电子排布式是___________;第4周期中基态原子未成对电子数与铜原子相同的元素有________种。
(2)Cu+能与SCN-形成CuSCN沉淀。请写出一种与SCN-互为等电子体的微粒_________。SCN-对应的酸有硫氰酸(H-S-CN)和异硫氰酸(H-N=C=S),这两种酸熔点更高的是_______(填名称),原因是_____________________。
(3)Cu2+能与NH3形成平面正方形的[Cu(NH3)4]2+。NH3分子的空间构型为__________;[Cu(NH3)4]2+中Cu采取dspx杂化,x的值是__________。
(4)已知Cu2O 熔点为1235 ℃,K2O 熔点为770℃,前者熔点较高,其原因是___________。
(5)Cu3N 的晶胞(立方)结构如下图所示:
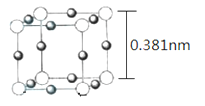
①距离最近的两个Cu+间的距离为________nm。(保留两位小数)
②Cu3N 晶体的密度为____________ g·cm-3。(NA表示阿伏伽德罗常数的值,列出计算式,不必计算出结果)
查看答案和解析>>
科目: 来源: 题型:
【题目】利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
i. CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1
CH3OH(g)+H2O(g) △H1
ii. CO(g)+2H2(g)![]() CH3OH(g) △H2
CH3OH(g) △H2
iii. CO2(g)+H2(g)![]() CO (g)+H2O(g) △H3
CO (g)+H2O(g) △H3
回答下列问题:
(1)已知反应ii中的相关的化学键键能(“C![]() O”表示CO的化学键)数据见表:
O”表示CO的化学键)数据见表:
化学键 | H-H | C-O | C | H-O | C-H |
E/(kJ·mol-1) | 436 | 343 | 1076 | 465 | 413 |
由此计算△H2=______________。
(2)反应i、ii、iii对应的平衡常数K1、K2、K3之间的关系式为_______________
(3)一定条件下,在2L的恒容密闭容器中充入1molCO2和2molH2发生反应i 。下图是反应体系中CO2的平衡转化率与温度的关系曲线。

①△H1_____0(填“大于”或“小于”)
②当温度为500K时,该反应10min达到平衡。0~10min时间内用CH3OH表示该反
应的化学反应速率为_____________________。
③若改充入1mol CO2和3mol H2,则图中的曲线会_________(填“上移”或“下移”)。
(4)在3 L容积可变的密闭容器中发生反应iii,已知c(CO)与反应时间t变化曲线Ⅰ如图所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ。当曲线Ⅰ变为曲线Ⅱ时,改变的条件是______;当曲线Ⅰ变为曲线Ⅲ时,改变的条件是_______。

(5)以甲醇为燃料,氧气为氧化剂,KOH溶液为电解质溶液,可制成燃料电池。以此电池作电源,在实验室中模拟铝制品表面“钝化”处理过程(装置如图所示)。其中物质b是__________, 阳极电极反应为_______________。

查看答案和解析>>
科目: 来源: 题型:
【题目】气体的体积主要由以下什么因素决定:( ) ①气体的分子多少 ②气体分子的大小
③气体分子间的平均距离 ④气体分子的相对分子质量.
A.①②
B.①③
C.②③
D.②④
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学学习小组设计了如下从海带灼烧后的海带灰中提取碘单质的流程:
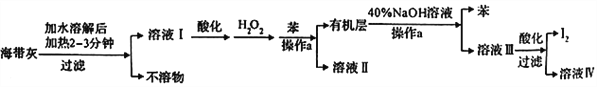
(1)溶解海带灰时要加热煮沸2~3min的目的是_________,操作a的名称是 _______。
(2)向酸化的溶液I中加入H2O2的目的是__________________________________。
(3)已知I2与40%的NaOH溶液反应生成的氧化产物和还原产物的物质的量之比为1:5,则发生反应的化学方程式是________________________________。
(4)最后过滤得到的I2需要进行洗涤和干燥,下列洗涤剂中最应该选用的是______。
a.热水 b.乙醇 c.冷水 d.二硫化碳
(5)用Na2S2O3的标准溶液测定产品的纯度,发生反应:I2+2Na2S2O3=Na2S4O6+2NaI。取5.0g产品,配制成100ml溶液。取10.00ml溶液,以淀粉溶液为指示剂,用浓度为0.050mol·L-1Na2S2O3的标准溶液进行滴定,相关数据记录如下表所示。
编号 | 1 | 2 | 3 |
溶液的体积/mL | 10.00 | 10.00 | 10.00 |
消耗Na2S2O3标准溶液的体积/mL | 19.95 | 17.10 | 20.05 |
滴定时,达到滴定终点的现象是________,碘单质在产品中的质量分数是________% 。
查看答案和解析>>
科目: 来源: 题型:
【题目】Na2Sx在碱性溶液中可被NaClO氧化为Na2SO4,而NaClO被还原为NaCl,若反应中Na2Sx与NaClO的物质的量之比为1:16,则x值是
A. 5 B. 4 C. 3 D. 2
查看答案和解析>>
科目: 来源: 题型:
【题目】已知常温时CH3COOH的电离平衡常数Ka=1.75×105,NH3·H2O的电离平衡常数Kb=1.75×105。常温时,向10 mL浓度均为0.01mol·L1的NaOH和氨水混合溶液中,逐滴加入0.01mol·L1的 CH3COOH 溶液,混合溶液的pH与加入CH3COOH的体积V之间的变化曲线如图所示,下列有关说法正确的是

A. a 点溶液的pH<12
B. b 点时水的电离程度最大
C. c 点处的微粒间存在:c(CH3COO)=c(NH4+)+c(NH3·H2O)
D. d 点处的微粒间存在:c(CH3COO)>c(H+)>c(Na+)>c(NH4+)>c(OH)
查看答案和解析>>
科目: 来源: 题型:
【题目】汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3= K2O+5Na2O+16N2↑,对于该反应,下列判断正确的是
A. NaN3中氮元素的化合价为-3
B. 氧化剂和还原剂是同一物质
C. 被氧化的氮原子与生成的氮气分子个数之比为15:8
D. 反应过程中若转移1mol电子,则产生2.24L气体(标准状况)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com