
科目: 来源: 题型:
【题目】铋及其化合物在工业生产中用途广泛,某研究小组用浮选过的辉铋矿(主要成分是Bi2S3,还含少量SiO2等杂质)制备NaBiO3,其流程如下:
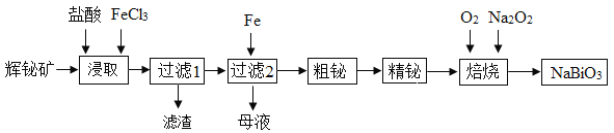
已知:水解能力:Bi3+>Fe3+。
回答下列问题:
(1)“浸取”时,为了提高浸取速率,可采取的措施有______(任写一条);过滤1的滤渣的主要成分有______(填化学式)。
(2)浸取时加入过量浓盐酸的目的是______;“母液”中通入气体X后可循环利用,气体X为______(填名称)。
(3)写出焙烧时生成铋酸钠的化学方程式______;当消耗标准状况下4.48 L O2时,转移电子的数目是______。
(4)25℃时,向浓度均为0.04 mol·L-1的Cu2+、Pb2+、Bi3+的混合溶液中滴加(NH4)2S溶液(设溶液体积增加1倍),当c(Pb2+)=10-5 mol·L-1时恰好完全沉淀,所得溶液中c(Cu2+)∶c(Bi3+)=______。[已知:Ksp(CuS)=6.0×10-36、Ksp(PbS)=3.0×10-28、Ksp(Bi2S3)=1.6×10-20]
(5)用双硫腙(H2Dz,二元弱酸)~CC14络合萃取法可从工业废水中提取金属离子:H2Dz先将金属离子络合成电中性的物质[如Cu(HDz)2等],再用CCl4萃取此络合物。下图是用上述方法处理含有Hg2+、Bi3+、Zn2+的废水时的酸度曲线(E%表示金属离子以络合物形式被萃取分离的百分率)。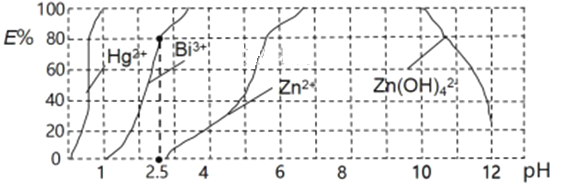
①当调节pH=2.5时,铋(Bi)的存在形式有______。
②向萃取后的CCl4中加入NaOH溶液可将铋元素以氢氧化物的形式沉淀下来,相应的离子方程式为______。
查看答案和解析>>
科目: 来源: 题型:
【题目】运用相关原理,回答问题:
Ⅰ.(1)25℃时,水的离子积Kw值为____________。
(2)在T℃的水溶液中,c(H+)=10x mol/L,c(OH-)=10y mol/L,x与y的关系如图所示:

①T℃下,水的离子积为_______________。
②T℃下,0.01 mol/L NaOH溶液中c(H+) 为____________mol/L。
Ⅱ.25℃时,电离平衡常数如下。回答下列问题:
化学式 | CH3COOH | H2S | HClO |
电离平衡常数 | 1.8×10-5 | K1=1.3×10-7 K2=7.1×10-15 | 3.0×10-8 |
(1)物质的量浓度均为0.1mol/L的下列四种物质:
a.Na2S b.NaClO c.CH3COONa d.NaHS
pH由大到小的顺序是____________________(填序号)。
(2)25℃时,0.1 mol/L的CH3COOH溶液加水稀释过程中,下列表达式的数据一定变小的是___________________。
a.c(H+) b.c(H+)/c(CH3COOH) c.c(H+)·c(OH-)
(3)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中 c(CH3COO-)-c(Na+)=______________mol/L(填数值)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组离子在无色酸性溶液中可以大量共存的有( )
A.Ag+、K+、NO3﹣、Cl ﹣
B.K+、Cu2+、SO42﹣、HCO3﹣
C.Mg2+、Cl﹣、SO42﹣、Na+
D.CO32﹣、K+、NO3﹣、Na+
查看答案和解析>>
科目: 来源: 题型:
【题目】海水中蕴藏着丰富的资源,在实验室中取少量海水,进行如下流程的实验:
![]()
![]()
![]() ―→
―→![]() ―→
―→![]()
粗盐中含Ca2+、Mg2+、Fe3+、SO![]() 等杂质,提纯的步骤有:
等杂质,提纯的步骤有:
①加入过量的Na2CO3溶液 ②加入过量的BaCl2溶液 ③加入过量的NaOH溶液 ④加入适量盐酸 ⑤溶解 ⑥过滤 ⑦蒸发,其正确的操作顺序是( )
A. ⑤②③①⑥④⑦ B. ⑤①②③⑥④⑦
C. ⑤②①③④⑥⑦ D. ⑤③①②⑥④⑦
查看答案和解析>>
科目: 来源: 题型:
【题目】电解质溶液电导率越大导电能力越强。常温下用0.100 mol·L-1盐酸分别滴定10.00 mL浓度均为0.100 mol·L-1的NaOH溶液和氨水溶液。利用传感器测得滴定过程中溶液的电导率如图所示。下列说法正确的是

A. 曲线①代表滴定氢氧化钠溶液的曲线
B. 滴定氨水的过程应该选择酚酞作为指示剂
C. b点溶液中:c(H+)>c(OH-)+c(NH4+)+c(NH3·H2O)
D. a、b、c、d四点的溶液中,水的电离程度最大的是c点
查看答案和解析>>
科目: 来源: 题型:
【题目】科学家发现对冶金硅进行电解精炼提纯可降低高纯硅制备成本。相关电解槽装置如图所示,用Cu-Si合金作硅源,在950℃利用三层液熔盐进行电解精炼,有关说法不正确的是
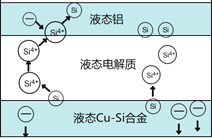
A. 在该液相熔体中Cu优先于Si被氧化,Si4+优先于Cu2+被还原
B. 电子由液态Cu-Si合金流出,从液态铝流入
C. 三层液熔盐的作用是增大电解反应面积,提高硅沉积效率
D. 电流强度不同,会影响硅提纯速率
查看答案和解析>>
科目: 来源: 题型:
【题目】某重要有机合成中间体X的结构如图所示,有关该物质的说法正确的是

A. X分子中所有碳原子一定共面
B. X可以使溴水、酸性KMnO4褪色,且原理不相同
C. 标况下1 molX分别和足量Na和NaHCO3反应,生成气体体积相同
D. X与庚二酸(![]() )互为同分异构体
)互为同分异构体
查看答案和解析>>
科目: 来源: 题型:
【题目】已知甲和乙为中学化学常见金属单质,丙和丁为常见气体单质,A~E为常见化合物;A为淡黄色固体,常温下B为液体,C的焰色反应为黄色。试回答下列问题:
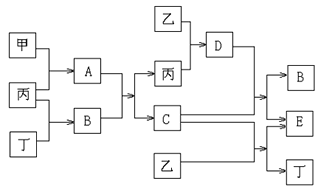
(1)A和E的化学式分别为_____________、____________;
(2)A+B→C+丙的化学方程式:__________________________________________ ;
(3)D+C→B+E的化学方程式:__________________________________________ ;
(4)1mol甲和1mol乙混合投入到足量的B中,在标准状况下,最多能产生丁气体______L。
查看答案和解析>>
科目: 来源: 题型:
【题目】20℃时H2S饱和液浓度为0.1 mol·L-1,电离方程式为H2S ![]() H++HS-,HS-
H++HS-,HS-![]() H++S2-,若要使该溶液H+浓度增大,同时使S2-浓度减小,可采取的措施是
H++S2-,若要使该溶液H+浓度增大,同时使S2-浓度减小,可采取的措施是
A. 加入少量的水 B. 加入少量的NaOH固体
C. 通入少量的SO2 D. 加入少量的CuSO4固体
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定条件下,对于反应mA(g)+nB(g) ![]() cC(g)+dD(g),C物质的质量分数(C%)随温度升高或压强增大而减小。下列判断正确的是
cC(g)+dD(g),C物质的质量分数(C%)随温度升高或压强增大而减小。下列判断正确的是
A. 该反应为放热反应
B. (m+n) >(c+d)
C. 减小压强,平衡正向移动,平衡常数K值增大
D. 达到平衡后,增加A的物质的量,平衡正向移动,A的转化率增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com