
科目: 来源: 题型:
【题目】Ⅰ.(1)①H2 + CuO ![]() Cu + H2O
Cu + H2O
②CaCO3 + 2HCl = CaCl2 + CO2↑ + H2O
③3S + 6NaOH ![]() 2Na2S + Na2SO3 + 3H2O
2Na2S + Na2SO3 + 3H2O
④NH4NO3 + Zn = ZnO + N2↑+ 2H2O
⑤Cu2O + 4HCl = 2HCuCl2 + H2O
上述反应中,属于氧化还原反应的是__________________________(填序号)
(2)SeO2、KI和HNO3可发生反应:SeO2+KI+HNO3→Se+I2+KNO3+H2O,配平该反应的化学方程式并用双线桥法标出电子转移的方向和数目:____________________________。
(3)在反应 KIO3 + 6HI = 3I2 + KI + 3H2O中,氧化剂与还原剂的物质的量之比为__________。
Ⅱ.已知:
① 2H2O + Cl2 + SO2 = H2SO4 + 2HCl ② 2KMnO4 + 16HCl = 2KCl + 2MnCl2 + 5Cl2↑ + 8H2O
(4)根据以上两个反应可以得出氧化剂和还原剂的强弱顺序,请写出由KMnO4、K2SO4 、MnSO4 、SO2、H2O、H2SO4 这六种物质组成的氧化还原反应的方程式并配平:_______________________。
在反应②中,若有18.25g HCl被氧化,求:
(5)转移的电子数为:_______________。
(6)标况下生成Cl2的体积(请列式计算)_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,用水稀释0.1 mol/L的醋酸溶液,随加水量的增加而增大的是( )
A.n(CH3COOH) B.c(H+) C. c(H+) ·c(OH-) D. c(H+)/c(CH3COOH)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列与金属腐蚀有关的说法正确的是( )
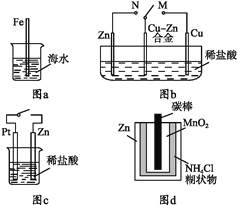
A. 图a中,插入海水中的铁棒,越靠近底端腐蚀越严重
B. 图b中,开关由M改置于N时,Cu-Zn合金的腐蚀速率减小
C. 图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大
D. 图d中,Zn-MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的
查看答案和解析>>
科目: 来源: 题型:
【题目】咖啡酸乙酯具有抗炎作用且有治疗自身免疫性疾病的潜力,其合成路线如图所示:

回答下列问题:
(1)C+D→E反应类型为______。F中含氧官能团的名称是______。
(2)D分子中位于同一平面上的原子最多有______个。G的结构简式为______。
(3)H→咖啡酸乙酯的化学方程式为______。
(4)芳香族化合物M是H的同分异构体,1 molM与足量碳酸氢钠溶液反应生成2 molCO2,M的结构有______种;其中核磁共振氢谱为5组峰,峰面积比为1∶2∶2∶2∶1的结构简式为______。
(5)以上图中的C和甲醛为原料,设计合成C5H12O4(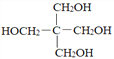 )的路线(无机试剂任任选)。________________________
)的路线(无机试剂任任选)。________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上电解制碱的技术是用离子交换膜法。请回答下列问题:
(1)电解精制食盐水,电解槽中的阳离子交换膜把电解槽隔成了阴极室和阳极室,它只允许阳离子通过,而不允许_____________(填离子符号)和气体通过。

(2)氯碱工业中获得的烧碱可以吸收有毒气体H2S,吸收后的溶液加入到如图所示的电解池的阳极区进行电解以获取单质硫。
①Na2S溶液显碱性的原因(离子方程式):____________________________________________________________。
②电极A应该与直流电源的____________相连。A电极反应为________________________________________________。
(3)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节电、节能30%以上。在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出。

①图示中电极产物X、Y分别是____________、____________(填化学式)。图示中氢氧化钠溶液质量分数大小:a%______b%(填“﹥”“﹤”或“=”)。
②燃料电池B中正极的电极反应:_________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】锰的化合物是优良的催化剂,并可用于干电池原料生产等。
(1)普通锌锰干电池的反应为:2MnO2+Zn+2NH4Cl=2MnO(OH)+Zn(NH3)2Cl2。
①MnO(OH)中锰元素的化合价为_________。电解质的主要成分是_____________________(填化学式);
②与普通锌锰电池相比,碱性锌锰电池_________(填序号)
a.比能量大 b.电流小
c.存储时间长 d.不能连续放电
(2)向普通锌锰废电池还原后的废液(含有Mn2+、Fe2+、Zn2+等)中逐滴滴加Na2S溶液,最先生成的沉淀为________________________(填化学式)。
已知:Ksp(MnS)=1.4×10-15,Ksp(ZnS)=2.9×10-25,Ksp(FeS)=6×10-18
(3)合成甲醇的反应为:CO2(g)+3H2(g)![]() CH3OH (g)+H2O (g)。此反应的平衡常数表达式为K=______________________________。锰的某化合物常做此反应的催化剂,关于此化合物说法正确的是_______(填序号)。
CH3OH (g)+H2O (g)。此反应的平衡常数表达式为K=______________________________。锰的某化合物常做此反应的催化剂,关于此化合物说法正确的是_______(填序号)。
a.可加快该反应速率 b.可增大该反应活化能
c.改变该反应平衡常数 d.提高该反应转化率
(4)向盛有4 mL 0.01mol/L KMnO4酸性溶液中滴入2 mL 0.1mol/L H2C2O4(草酸)溶液,开始颜色变化不明显,一段时间后,颜色变化突然加快,颜色很快消失。分析产生此现象的可能原因____________(填序号)。
a.该反应为放热反应,放出的热量加快反应速率
b.溶液呈酸性,H+ 起催化作用
c.K+ 起催化作用
d.反应产生的Mn2+ 起催化作用
(5)Mn2+催化H2O2分解:2H2O2(l)=2H2O(l)+O2(g) ΔH1,其反应机理如右图示。已知反应Ⅱ为:MnO2(s)+H2O2(1)+2H+(aq)=Mn2+(aq)+O2(g)+2H2O(1) ΔH2。
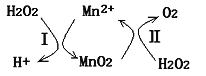
写出反应 I的热化学方程式(焓变用ΔH1和ΔH2表示):____________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】氨在国民经济中占有重要地位。完成合成氨工业中有关问题。
(1)合成氨工业中,合成塔中每产生2 mol NH3,放出92.2 kJ热量。
①高温高压、催化剂条件下,工业合成氨的热化学方程式为:____________________________________________。
②若起始时向容器内放入0.2 mol N2和0.6 mol H2,达到平衡后放出的热量为Q,则Q值______18.44 kJ(填“﹥”“=”或“﹤”)。
(2)NH3(g)与CO2(g) 经过两步反应合成尿素(CO(NH2)2),两步反应的能量变化示意图如下:

①则2NH3(g)+CO2(g) ![]() CO(NH2)2(s)+H2O(l) ΔH=_________kJ/mol。
CO(NH2)2(s)+H2O(l) ΔH=_________kJ/mol。
②在一定温度和压强下,若①中的反应,NH3和CO2的物质的量之比(氨碳比)n(NH3)/n(CO2)=x。下图是氨碳比(x)与CO2平衡转化率(α)的关系。

α随着x增大而增大的原因是_________________________________。
③图中B点处,NH3的平衡转化率_______________。
(3)将N2和H2各1 mol充入一密闭容器中,在一定条件下发生合成氨反应。反应至平衡的过程中,N2的体积分数将_______________(填序号)。
a.一直减小 b.始终不变 c.一直增大 d.无法确定
查看答案和解析>>
科目: 来源: 题型:
【题目】汽车剧烈碰撞时,安全气囊中发生反应:10NaN3+2KNO3=K2O+5Na2O+16N2↑下列说法正确的是( )
A. KNO3是还原剂,其中氮元素被氧化
B. 生成物中的N2是氧化产物,K2O是还原产物
C. 每转移1 mol电子,可生成N2的体积为35.84 L
D. 若有65 g NaN3参加反应,则被氧化的N的物质的量为3 mol
查看答案和解析>>
科目: 来源: 题型:
【题目】向含有KI、NaBr的混合溶液中通入过量的Cl2充分反应.将溶液蒸干并灼烧,最后剩余的固体物质是( )
A.KI和NaBr
B.KCl和NaCl
C.KCl和NaBr
D.KCl、NaCl和I2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com