
科目: 来源: 题型:
【题目】I.下图所示装置,装置A是氢氧燃料电池,已知该装置工作时电子从b极流向Fe电极。
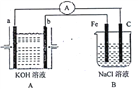
(1)C电极反应式为___________________________。
(2)若装置B中溶液体积为100mL,假设反应前后溶液体积不变,当装置A中消耗0.05mol氢气时,装置B中溶液的pH为_____,此时要恢复原溶液的浓度需加入______(填化学式)。
(3)若将装置B改为电解精炼铜,则粗铜作____极,阴极反应为_________。
II.用零价铁(Fe)去除水体中的的硝酸盐(NO3-)已成为环境修复研究的热点之一。
(1)Fe还原水体中(NO3-)的反应原理如图所示。

①作负极的物质是_______________。②正极的电极反应式是_________________________。
(2)研究证实,CO2也可在酸性水溶液中通过电解生成甲醇,则生成甲醇的反应发生在___极,该电极反应式是_______________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】氢能是一种高效清洁、极具发展潜力的能源。利用生物质发酵得到的乙醇制取氢气,具有良好的应用前景。
已知下列反应:
反应I:CH3CH2OH(g)+H2O(g) ![]() 2CO(g)+4H2(g) △H1
2CO(g)+4H2(g) △H1
反应Ⅱ:CO(g)+ H2O(g) ![]() CO2(g)+ H2(g) △H2
CO2(g)+ H2(g) △H2
反应Ⅲ:2 CO2(g)+ 6H2(g) ![]() CH3CH2OH(g)+3H2O(g) △H3
CH3CH2OH(g)+3H2O(g) △H3
反应Ⅳ:6H2(g)+2CO2(g) ![]() CH2=CH2(g)+4H2O(g) △H4
CH2=CH2(g)+4H2O(g) △H4
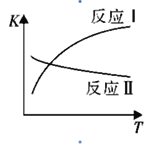
(1)反应I和反应II的平衡常数随温度变化曲线如图所示。则△H1 _________△H2(填“>”、“<”或“=”);△H3=_________(用△H1、△H2表示)。
(2)向2L密闭容器中充入H2和CO2共6mol,改变氢碳比[n(H2)/n(CO2)]在不同温度下发生反应III达到平衡状态,测得的实验数据如下表。分析表中数据回答下列问题:
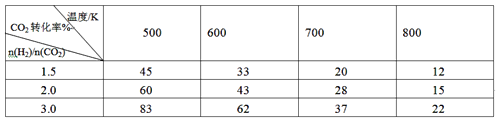
①温度升高,K值__________(填“增大”、“减小”、或“不变”)。
②提高氢碳比,K值____(填“增大”、“减小”、或“不变”),对生成乙醇______(填“有利”或“不利”)。
③在700K、 氢碳比为1.5,若5min反应达到平衡状态,则0~5min用H2表示的速率为__________。
(3)反应III在经CO2饱和处理的KHCO3电解液中,电解活化CO2制备乙醇的原理如图所示。
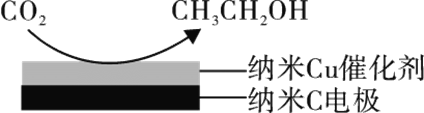
①阴极的电极反应式为________。
②从电解后溶液中分离出乙醇的操作方法为________。
(4)在一定条件下发生反应Ⅳ,测得不同温度对CO2的平衡转化率及催化剂的效率影响如图所示,下列有关说法正确的为________(填序号)。
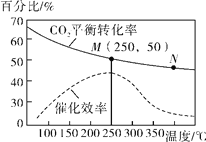
①不同条件下反应,N点的速率最大
②M点平衡常数比N点平衡常数大
③温度低于250℃时,随温度升高乙烯的产率增大
④实际反应应尽可能在较低的温度下进行,以提高CO2的平衡转化率。
查看答案和解析>>
科目: 来源: 题型:
【题目】下图表示细胞内某些有机物的元素组成和功能关系,其中A、B代表元素,Ⅰ、Ⅱ、Ⅲ、Ⅳ是生物大分子,图中X、Y、Z、P分别为构成生物大分子的基本单位。请回答下列问题:
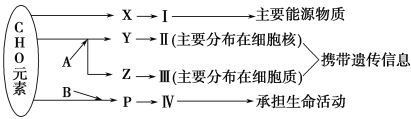
(1)图中X是________,Ⅰ在小麦种子中主要是指__________,在动物细胞是指_________。
(2)图中A是指________,Y为__________ ,由它合成的Ⅱ是__________。
(3)图中________是大肠杆菌的遗传物质,图中_______是HIV的遗传物质。
(4)图中P生成Ⅳ反应场所是________。
(5)构成细胞的化合物中,随着年龄增长会明显减少的主要是_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,回答下列关于酸和碱中和反应的问题:
将某一元酸HA 和NaOH溶液等体积混合,分别进行编号①、②、③的实验,实验数据记录事表
序号 | HA物质的量浓度(mol/L) | NaOH物质的量浓度(mol/L) | 混合溶液的pH |
① | 0.1 | 0.1 | pH=9 |
② | c | 0.2 | pH=7 |
③ | 0.2 | 0.1 | pH>9 |
请回答:
(1)根据①组实验情况,混合溶液pH=9的原因是_____________(用离子方程式表示)。
(2)混合溶液①中由水电离出的c (H+)_____0.1moI/LNaOH溶液中由水电离出的c(H+)。(填“>”“<”或“=”)
(3)根据①组实验情况,在该溶液中下列关系式正确的是(填序号字母)______。
A.c(Na+)+c(H+) =c(OH-) +c(A-)
B.c(Na+) =c(HA) +c(A-)
C.c (HA)+c(H+) =c(OH-)
D.c(Na+) +c(H+) =c(OH-) +c(A-) +c (HA)
(4)②组情况表明,c_________0.2mol/L (选填“>”、“<”或“=”)。混合溶液中离子浓度c(A-)____c(Na+) (选填“>”、“<”或“=”)。
(5)从③组实验结果分析,离子浓度由大到小的顺序是_________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(III)的处理工艺流程如下:

已知:
①硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
②常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
阳离子 | Fe3+ | Mg2+ | Al3+ | Cr3+ |
沉淀完全时的pH | 3.7 | 11.1 | 5.4(>8溶解) | 9(>9溶解) |
(1)酸浸时,为了提高浸取率可采取的措施有_________________(写出两条)。
(2)过滤操作时所用玻璃仪器除烧杯外,还需要________________。
(3)H2O2的作用是将滤液I中的Cr3+转化为C2O72-,该反应的离子方程式为:____________________。
(4)加入NaOH溶液调节溶液pH=8,既可以使溶液中某些杂质离子转化为沉淀,同时又可以将Cr2O72-转化为________(填微粒的化学式),当溶液的pH>8时,沉淀的主要成份为________ (填化学式)。
(5)钠离子交换树脂的反应原理为:Mn++nNaR=MRn+nNa+,则利用钠离子交换树脂可除去滤液Ⅱ中的金属阳离子有________________,交换后溶液中浓度明显增大的离子为________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下将KOH溶液滴加到己二酸(H2X) 溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述正确的是
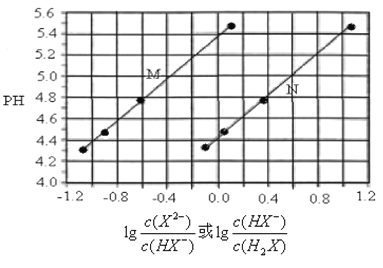
A. Ka2(H2X)的数量级为10–4
B. KHX溶液中c(H+)>c(OH-)
C. 曲线N表示pH与1g[c(X2-)/c(HX-)]的变化关系
D. 当混合溶液呈中性时,c(K+) >c(HX-) > c(X2-) > c(OH-) =c(H+)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是
A. 向0.1mol/L CH3COOH溶液中加入少量水,溶液中c(H+)/c(CH3COOH)减小
B. 将CH3COONa溶液从20℃升温至30℃,溶液中c(CH3COO-)/[c(CH3COOH).c(OH-)]增大
C. 向盐酸中加入氨水至中性,溶液中[c(NH4+)/c(Cl-)]>1
D. 向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中c(Cl-)/c(Br-)不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com