
科目: 来源: 题型:
【题目】将V1mL1.00mol·L-1HCl溶液和V2mL未如浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL)。下列叙述正确的是( )

A. 做该实验时环境温度为22℃ B. 该实验表明化学能可以转化为热能
C. NaOH溶液的浓度约为1.00mol·L-1 D. 该实验表明有水生成的反应都是放热反应
查看答案和解析>>
科目: 来源: 题型:
【题目】ClO2是新一代饮用水的消毒剂,许多发达国家的自来水厂采用ClO2代替Cl2来进行自来水消毒。我国最近成功研究出制取ClO2的新方法,其反应的微观过程如下所示:

下列有关该反应的叙述中正确的是( )
A.该反应是复分解反应
B.该反应的化学方程式为Cl2+2NaClO2===2ClO2+2NaCl
C.反应中Cl2既是氧化剂,又是还原剂
D.NaClO2和ClO2中Cl的化合价相同
查看答案和解析>>
科目: 来源: 题型:
【题目】我国是世界上最大的钨储藏国。金属钨可用于制造灯丝、超硬模具和光学仪器。在工业上常采用高温还原WO3法制取金属钨。回答下列问题:
(1)白钨矿(主要成分是CaWO4)与盐酸反应生成沉淀,灼烧沉淀即可得到WO3,上述两步反应的化学方程式为_________________、__________________。
(2)T℃时,WO3经如下的四步反应生成W。每一步反应的焓变和平衡常数如下: WO3(s)+0.1H2(g)![]() WO2.9(s)+0.1H2O(g) △H1 K1
WO2.9(s)+0.1H2O(g) △H1 K1
WO2.9(s)+0.18H2(g)![]() WO2.72(s)+0.18H2O(g) △H2 K2
WO2.72(s)+0.18H2O(g) △H2 K2
WO2.72(s)+0.72H2(g)![]() WO2(s)+0.72H2O(g) △H3 K3
WO2(s)+0.72H2O(g) △H3 K3
WO2(s)+2H2(g)![]() W(s)+2H2O(g) △H4 K4
W(s)+2H2O(g) △H4 K4
则该温度下,WO3(s)+3H2(g)![]() W(s)+3H2O(g) △H=_________,K=__________。
W(s)+3H2O(g) △H=_________,K=__________。
(3)T1℃时,将一定质量WO3和8.0gH2置于2L密闭容器中,发生反应: WO3(s)+3H2(g)![]() W(s)+3H2O(g),混合气体各组分物质的量之比随时间变化的关系如图所示:
W(s)+3H2O(g),混合气体各组分物质的量之比随时间变化的关系如图所示:

①T1℃时,H2的平衡转化率a=_________%,反应平衡常数K=__________。
②若在4min时降低并维持温度为T2℃,则该反应的△H_______0,若在8min时缩小容器容积,则![]() _________1.3。(填“>”“ <”或“=”)
_________1.3。(填“>”“ <”或“=”)
查看答案和解析>>
科目: 来源: 题型:
【题目】FeCl3具有净水作用,但腐蚀设备,而聚合氧化铁是一种新型的絮凝剂,处理污水比FeCl3 高效,且腐蚀性小。请回答下列问题:
(1)FeCl3净水的原理是__________________,FeCl3溶液腐蚀钢铁设备,除H+作用外,另一主要原因是(用离了方程式表示)___________________________。
(2)为节约成本,工业上用NaClO3 氧化酸性FeCl2 废液得到FeCl3。
①若酸性FeCl2溶液中c(Fe2+)=2.0×10-2mol/L,c(Fe3+)=1.0×10-3mol/L,c(Cl-)=5.3×10-2mol/L,则该溶液的pH约为________________。
②完成NaClO3氧化FeCl2的离子方程式:□ClO3-+□Fe2++□___=□Cl-+□Fe3++□____。
(3)FeCl3在溶液中分三步水解:
Fe3++H2O![]() Fe(OH)2++H+ K1
Fe(OH)2++H+ K1
Fe(OH)2++H2O![]() Fe(OH)2++H+ K2
Fe(OH)2++H+ K2
Fe(OH)++H2O![]() Fe(OH)3+H+ K3
Fe(OH)3+H+ K3
以上水解反应的平衡常数K1、K2、K3由大到小的顺序是________________________。
通过控制条件,以上水解产物聚合,生成聚合氧化铁,离子方程式为:xFe3++yH2O![]() Fex(OH)y(3x-y)++yH+
Fex(OH)y(3x-y)++yH+
欲使平衡正向移动可采用的方法是(填序号)___________。
a.降温 b.加水稀释 c.加入NH4Cl d.加入NaHCO3
室温下,使氯化铁溶液转化为高浓度聚合氯化铁的关键条件是_______________________。
(4)天津某污水处理厂用氯化铁净化污水的结果如图所示。由图中数据得出每升污水中投放聚合氯化铁[以Fe(mg·L-1)表示]的最佳范围约为_________mg·L-1。
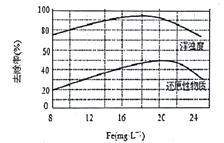
查看答案和解析>>
科目: 来源: 题型:
【题目】将30 mL 0.5 mol·L-1 NaOH溶液加水稀释到500 mL,关于稀释后的溶液叙述不正确的是( )
A. 浓度为0.03 mol·L-1 B. 从中取出10 mL溶液,其浓度为0.03 mol·L-1
C. 含NaOH 0.6 g D. 从中取出10 mL溶液,含NaOH 0.015 mol
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应属于加成反应的是( )
A.乙醇与钠反应生成乙醇钠和氢气
B.乙烯与氯化氢反应生成一氯乙烷
C.乙酸与乙醇反应生成乙酸乙酯和水
D.甲烷与氯气反应生成一氯甲烷和氯化氢
查看答案和解析>>
科目: 来源: 题型:
【题目】NH4Al(SO4)2在食品、医药、电子工业中用途广泛。回答下列问题:
(1)NH4Al(SO4)2可做净水剂,其理由是____________________(用离子方程式表示)。
(2)相同条件下,0.1mol/LNH4Al(SO4)2溶液中,c(NH4+)_____0.1mol/LNH4HSO4溶液中c(NH4+)(填“大于”、“等于”或“小于”)。
(3)下图是0.1mol/L 电解质溶液的pH 随温度变化的图像。

①其中符合0.1mol/LNH4Al(SO4)2溶液的是________(填字母)。导致溶液pH随温度变化的原因是_____________________________。
②20℃时,0.1mol/LNH4Al(SO4)2溶液中,2c(SO42-)-c(NH4+) -3c(Al3+)=_____mol/L。
(4)室温时,向0.1mol/LNH4Al(SO4)2溶液中滴加0.1mol/LNaOH 溶液。得到溶液pH与NaOH溶液体积关系曲线如图所示:
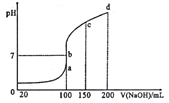
①已知:Ksp[Al(OH)3]=1×10-33,Al3+沉淀完全时(使其浓度小于1×10-6mol·L-1),溶液的pH=_______,试分析图中a、b、c、d四点,水的电离程度最大的是______________________。
②在b点,溶液中各离子浓度由大到小的顺序是_______________。
③b-c段随着NaOH的加入,溶液中c(NH3·H2O)/c(OH-)的值_____(填“增大”、“减小”或 “不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com