
科目: 来源: 题型:
【题目】根据要求完成下列各小题:
Ⅰ.(1)理论上稀的强酸、强碱反应生成1molH2O(l)时放出57.3kJ的热量,写出表示稀硫酸和稀氢氧化钠溶液反应的中和热的热化学方程式__________________________。
(2)已知:乙苯催化脱氢制苯乙烯反应:![]() +H2(g)
+H2(g)
化学键 | C-H | C-C | C=C | H-H |
键能/kJmol-1 | 412 | 348 | 612 | 436 |
计算上述反应的△H=_________kJmol-1。
Ⅱ.25℃时,部分物质的电离平衡常数如表所示,请回答下列问题:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
(1)CH3COOH、H2CO3、HClO的酸性由强到弱的顺序为_____________________________。
(2)将少量CO2气体通入NaClO溶液中,写出反应的离子方程式:____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去)。则W、X不可能是
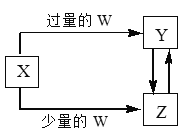
选项 | W | X |
A | 盐酸 | 碳酸钠溶液 |
B | 氢氧化钠溶液 | 氯化铝溶液 |
C | 二氧化碳 | 氢氧化钙溶液 |
D | 氯气 | 铁单质 |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】碳的化合物在生产生活和环境保护中应用广泛。
Ⅰ.碳氧化合物的综合利用
(1)利用CO可有效降低柴油发动机在空气过量条件下的NO 排放。
已知:反应Ⅰ:2CO(g)+2NO(g)![]() N2(g)+2CO2(g) △H=-746 kJ·mol-1
N2(g)+2CO2(g) △H=-746 kJ·mol-1
反应Ⅱ:4CO(B)+2NO2(g)![]() N2(g)+4CO2(g) △H=-1200kJ·mol-1
N2(g)+4CO2(g) △H=-1200kJ·mol-1
则反应NO2(g)+CO(g)![]() CO2(g)+NO(g)的△H=__________kJ·mol-1。
CO2(g)+NO(g)的△H=__________kJ·mol-1。
在一定条件下,将NO2与CO以体积比1:2置于恒容密闭容器中发生反应Ⅱ,下列能说明反应达到平衡状态的是______________。
a.体系压强保持不变 b.容器中气体密度保持不变
c.混合气体颜色保持不变 d.NO2 与CO的体积比保持不变
(2)工业上利用CO 与Cl2在活性炭催化下合成光(COCl2),反应方程式为: CO(g) +Cl2(g) ![]() COCl2(g) △H<0。某研究小组在恒温条件下,向2L恒容容器中加入0.2molCO和0.2molCl2,10min时达到平衡,测得10min 内v(COCl2)=7.5×10-3mol·L-1·min-1,则平衡时n(Cl2)=________ mol,设此时CO的转化率为a1,若其它条件不变,上述反应在恒压条件下进行,平衡时CO的转化率为a2,则a1_______a2 (填“>”“=”或“<”)
COCl2(g) △H<0。某研究小组在恒温条件下,向2L恒容容器中加入0.2molCO和0.2molCl2,10min时达到平衡,测得10min 内v(COCl2)=7.5×10-3mol·L-1·min-1,则平衡时n(Cl2)=________ mol,设此时CO的转化率为a1,若其它条件不变,上述反应在恒压条件下进行,平衡时CO的转化率为a2,则a1_______a2 (填“>”“=”或“<”)
(3)利用“组合转化技术”可将CO2 转化成乙烯,反应方程式为:6H2(g)+2CO2(g)![]() CH2=CH2(g)+4H2O(g)。实验测得温度对CO2 平衡转化率、催化剂催化效率的影响如图a所示。下列说法正确的是________________
CH2=CH2(g)+4H2O(g)。实验测得温度对CO2 平衡转化率、催化剂催化效率的影响如图a所示。下列说法正确的是________________
a.N点正反应速率一定大于M 点正反应速率
b.250℃时,催化剂的催化效率最大
c.M点平衡常数比N点平衡常数大
d.随着温度升高,乙烯的产率增大
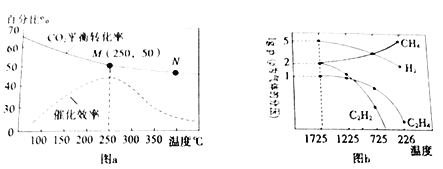
Ⅱ.碳氢化合物的综合利用
利用甲烷的裂解可以制得多种化工原料,甲烷裂解时发生的反应有:2CH4(g)![]() C2H4(g)+2H2(g),2CH4(g)
C2H4(g)+2H2(g),2CH4(g)![]() C2H2(g)+3H2(g) 。实验测得平衡时气体分压(Pa)与温度(℃)之间的关系如图b所示(气体分压=总压×气体的物质的量分数)。
C2H2(g)+3H2(g) 。实验测得平衡时气体分压(Pa)与温度(℃)之间的关系如图b所示(气体分压=总压×气体的物质的量分数)。
(4)1725 ℃时,向1L恒容密闭容器中充入0.3 molCH4达到平衡,则反应2CH4(g)![]() C2H4(g)+2H2(g)的平衡常数KP=___________(用平衡分压代替平衡浓度),CH4生成C2H2 的平衡转化率为__________________。
C2H4(g)+2H2(g)的平衡常数KP=___________(用平衡分压代替平衡浓度),CH4生成C2H2 的平衡转化率为__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】碲(Te)为第五周期元素,与氧同主族,其单质和化合物在化工生产等方面具有广泛应用。
(1)画出碲的原子结构示意图___________________。
(2)已知TeO2微溶于水,易溶于较浓的强酸和强碱。写出TeO2溶于浓氢氧化钠溶液的离子方程式_________________________。
(3)工业上用铜阳极泥(主要成分为Cu2Te,还含有少量的Ag、Au)为原料制备单质碲的工艺流程如下:

①“加压浸出”过程中被氧化的元素为_____________(填元素符号),1molCu2Te被“浸出”时氧化剂得到的电子数为___________________。
②“酸浸”时,温度过高会使碲的浸出率降低,原因为____________________。
③“还原”过程的化学方程式为____________________。
④工业上还可以将铜阳极泥煅烧、碱浸后得到Na2TeO3溶液,然后再通过电解的方法得到单质碲,阴极的电极反应式为______________________ 。
(4)25℃时,向1mol·L-1的Na2TeO3溶液中滴加盐酸,当溶液pH约为6时,此时溶液中c(HTeO3-):c(TeO32-)=_____________。(H2TeO3的Ka1=1.0×10-3,Ka2=2.0×10-8)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法不正确的是
A. 增大压强,活化分子百分数不变,化学反应速率增大
B. 升高温度,活化分子百分数增大,化学反应速率增大
C. 增大反应物浓度,活化分子百分数增大,化学反应速率增大
D. 使用催化剂,活化分子百分数增大,化学反应速率增大
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下将NaOH溶液分别滴加到两种一元弱酸HA和HB中,两种混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是

A. 电离常数:Ka(HB)>Ka(HA)
B. Ka(HA)的数量级为10-5
C. 当HA与NaOH溶液混合至中性时:c(A-)=c(HA)
D. 等浓度等体积的HA和NaB混合后所得溶液中:c(H+)>c(OH-)
查看答案和解析>>
科目: 来源: 题型:
【题目】在t℃时,Ag2CrO4(橘红色)在水溶液中的沉淀溶解平衡曲线如图所示.又知AgCl的Ksp=1.8×10-10。下列说法不正确的是( )

A. t℃时,Y点和Z点时Ag2CrO4的Ksp相等
B. 饱和Ag2CrO4溶液中加入K2CrO4不能使溶液由Y点变为X点
C. t℃时,Ag2CrO4的Ksp为1×10-8
D. t℃时,将0.01mol·L-1 AgNO3溶液滴入20mL0.01mol·L-1 KCl和0.01mol·L-1 K2CrO4的混合溶液中,Cl-先沉淀
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法不正确的是
A. 二氧化氮会导致酸雨和光化学烟雾,危害较大
B. 铝的氧化物熔点高,常用于制造耐火材料
C. 人体中极少量的NO会促进血管扩张,可防止血管栓塞
D. Al(OH)3胶体能凝聚水中的悬浮物并使之沉降,因此明矾常用于自来水消毒剂
查看答案和解析>>
科目: 来源: 题型:
【题目】亚磷酸(H3PO3)是二元弱酸,亚磷酸主要用作尼龙增白剂,电解Na2HPO3溶液也可得到亚磷酸,装置示意图如图(其中阳膜只允许阳离子通过,阴膜只允许阴离子通过)。下列说法不正确的是

A. 阳极的电极反应式为2H2O-4e-![]() 4H++O2↑
4H++O2↑
B. 产品室中发生的离子反应为HPO32-+2H+![]() H3PO3
H3PO3
C. 原料室中Na+浓度保持不变
D. 阴极室中溶液的pH逐渐升高
查看答案和解析>>
科目: 来源: 题型:
【题目】某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂。下列操作中可能使所测NaOH溶液的浓度数值偏低的是
A. 酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B. 滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C. 酸式滴定管在滴定前有气泡,滴定后气泡消失
D. 读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com