
科目: 来源: 题型:
【题目】实验室欲用NaOH固体配制1.0 mol·L-1的NaOH溶液240 mL:
(1)配制溶液时,一般可以分为以下几个步骤:
①称量 ②计算 ③溶解 ④摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却 ⑨摇动
其正确的操作顺序为________________。必须用到的玻璃仪器有烧杯、胶头滴管、_________。
(2)某同学欲称量NaOH的质量,他先用托盘天平称量烧杯的质量,天平平衡后的状态如图所示。烧杯的实际质量为________g,要完成本实验该同学应称出________g NaOH。

(3)如图是该同学转移溶液的示意图,图中有两处错误,请写出:

①________________________。
②_____________________________。
(4)在配制过程中,其他操作都是正确的,下列操作会引起误差偏高的是________(填字母)。
A.所用NaOH已经潮解
B.向容量瓶中加水未到刻度线
C.有少量NaOH溶液残留在烧杯里
D.用带游码的托盘天平称5.4 g NaOH(1 g以下用游码)时误用了“左码右物”方法
查看答案和解析>>
科目: 来源: 题型:
【题目】2-苯基丙烯酸(俗名阿托酸)是一种重要的医药中间体、材料中间体,其工业合成方法(从F开始有两条合成路线)如下:

已知:i. ![]()
ii. ![]()
iii. 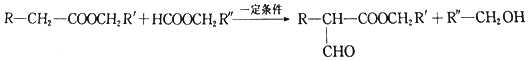
回答下列问题:
(1)C的名称为_____________,反应④的反应类型为___________________。
(2)检验E是否完全转化为F的试剂是________________________。
(3)反应③的化学方程式为_______________________。
(4)D的同分异构体有多种,符合下列条件的D的同分异构体有______________,其中苯环上的一元取代物有2种的结构简式为___________________ 。
①能发生银镜反应 ②能与FeCl3溶液发生显色反应
③核磁共振氢谱的峰面积比为6:2:2:1:1
(5)路线二与路线一相比不太理想,理由是_____________________。
(6)参照上述合成路线,设计一条由CH3COOH制备HOOCCH2COOH的合成路线。(合成路线的表示方法为:A![]() B……
B……![]() 目标产物)___________________
目标产物)___________________
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关物质用途的说法中,不正确的是( )
A.SO2可用于漂白纸浆
B.SiO2是良好的半导体材料
C.Na2O2可用作潜水艇O2来源
D.Cl2可用于消毒和制造漂白粉
查看答案和解析>>
科目: 来源: 题型:
【题目】下列措施或事实能用勒沙特列原理解释的是( )
A.在合成氨(正反应是放热)的反应中,升温有利于氨的合成
B.H2、I2、HI三者的平衡混合气,加压(缩小容器体积)后颜色变深
C.钢铁在潮湿的空气中更容易生锈
D.氯气可以用排饱和食盐水的方法收集
查看答案和解析>>
科目: 来源: 题型:
【题目】硼、镁及其化合物在工农业生产中应用广泛。已知:硼镁矿主要成分为Mg2B2O5H2O,硼砂的化学式为Na2B4O710H2O,利用硼镁矿制取金属镁及粗硼的工艺流程如下,请回答下列有关问题:
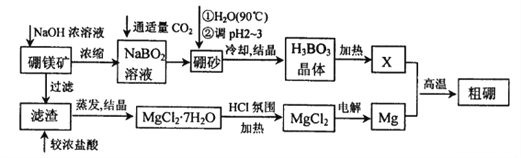
(1)硼砂中B的化合价为_________;滤渣的主要成分为_______________。
(2)X为H3BO3晶体加热脱水的产物,其与Mg制取粗硼的化学方程式为_________________________。
(3)H3BO3是一种一元弱酸,也可写作B(OH)3,它与水作用时结合水电离的OH-而呈酸性,这一变化的离子方程式为______________________________。
(4)MgCl2·6H2O需要在HCl氛围中加热,其目的是______________________。
(5)已知25℃时,Ksp[Mg(OH)2]=5.6×10-12;酸碱指示剂百里酚蓝变色的pH范围如下:
pH | <8.0 | 8.0~9.6 | >9.6 |
颜色 | 黄色 | 绿色 | 蓝色 |
在Mg(OH)2饱和溶液中滴加2滴百里酚蓝指示剂,溶液的颜色为_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某合成气的主要成分是一氧化碳和氢气,可用于合成甲醚(CH3OCH3)等清洁燃料。由天然气获得该合成气过程中可能发生的反应有:
①CH4(g)+H2O(g)![]() CO(g)+3H2(g) ΔH1=+206.1 kJ·mol-1
CO(g)+3H2(g) ΔH1=+206.1 kJ·mol-1
②CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) ΔH2=+247.3 kJ·mol-1
2CO(g)+2H2(g) ΔH2=+247.3 kJ·mol-1
③CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH3
CO2(g)+H2(g) ΔH3
请回答下列问题:
(1)在一密闭容器中进行反应①,测得CH4的物质的量浓度随反应时间的变化如图所示,则在10 min时,改变的外界条件可能是__________________________。

(2)反应③中ΔH3=_____________。800 ℃时,反应③的平衡常数K=1,测得该温度下密闭容器中某时刻各物质的物质的量见下表:
CO | H2O | CO2 | H2 |
0.5 mol | 8.5 mol | 2.0 mol | 2.0 mol |
此时反应③中正、逆反应速率的关系式是_________(填代号)。
a.v正>v逆 b.v正<逆 c.v正=v逆 d.无法判断
(3)如图2所示,在甲、乙两容器中分别充入等物质的量的CH4和CO2,使甲、乙两容器初始容积相等。在相同温度下发生反应②,并维持反应过程中温度不变。已知甲容器中CH4的转化率随时间的变化如图3所示,请在图3中画出乙容器中CH4的转化率随时间变化的图像。___________

(4)某合成气的主要成分中的一氧化碳,在一定条件下也可用NaOH溶液与CO反应生成甲酸钠(HCOONa),进一步反应生成甲酸来消除CO污染。常温下将a mol的CO通入2 L b mol·L-1NaOH溶液中,恰好完全反应生成甲酸钠和含少量甲酸的混合溶液(假设溶液体积不变),测得溶液中c(Na+)=c(HCOO-),则该混合溶液中甲酸的电离平衡常数Ka=_________(用含a和b的代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某小组同学为探究H2O2、H2SO3、Br2氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)。
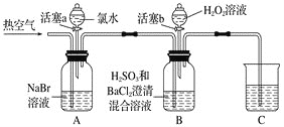
实验记录如下:
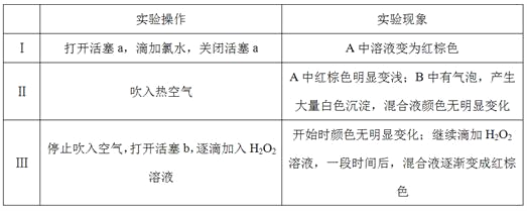
请回答下列问题:
(1)A中反应的离子方程式是__________________________________________________。
(2)实验操作Ⅱ吹入热空气的目的是_________________________________________。
(3)装置C的作用是____________,C中盛放的药品是_____________。
(4)实验操作Ⅲ,混合液逐渐变成红棕色,其对应的离子方程式_______________________。
(5)由上述实验得出的结论是_________________________________________________。
(6)实验反思:
①有同学认为实验操作Ⅱ吹入的热空气,会干扰(5)中结论的得出,你认为是否干扰,理由是_____________________________________________________________________。
②实验操作Ⅲ,开始时颜色无明显变化的原因是(写出一条即可):____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】叠氮化钠(NaN3)固体易溶于水,微溶于乙醇,不溶于乙醚,是汽车安全气囊中的主要成分,能在发生碰撞的瞬间分解产生大量气体将气囊鼓起。工业级NaN3 的制备分两步进行,反应方程式如下:
ⅰ.2Na+2NH3![]() 2NaNH2+H2
2NaNH2+H2
ⅱ.NaNH2+N2O![]() NaN3+H2O
NaN3+H2O
实验室利用如下装 置模拟工业级NaN3的制备。

回答下列问题:
实验Ⅰ:制备
(1)装置C中盛放的药品为____________________,装置D中进行油浴而不用水浴的主要原因是_______________________。
(2)N2O可由NH4NO3在240~245℃ 分解制得(硝酸铵的熔点为169.6℃),则可选择的气体发生装置是__________________(图中加热装置已略去),该反应的化学方程式为______________,在制备NaN3的实验过程中,当观察到_______________时开始通入N2O。

实验Ⅱ:分离提纯
反应完全结束后,取出装置D中的混合物进行以下操作,得到NaN3固体。

已知:NaNH2能与水反应生成NaOH 和氨气
(3)操作Ⅳ采用乙醚洗涤的原因是________________________。
实验Ⅲ:定量测定
实验室用滴定法测定叠氮化钠样品中NaN3的质量分数:①将2.500 g试样配成500.00 mL溶液。②取50.00 mL溶液置于锥形瓶中,加入50.00 mL 0.1010 mol·L-1(NH4)2Ce(NO3)6 溶液。③充分反应后,将溶液稍稀释,向溶液中加入8 mL浓硫酸,滴入3滴邻菲哕啉指示液,用0.0500 mol·L-1(NH4)2Fe(SO4)2标准溶液滴定过量的Ce4+,消耗溶液体积为29.00mL。测定过程的反应方程式为:2(NH4)2Ce(NO3)6+2NaN3=4NH4NO3+2Ce(NO3)3+2NaNO3+3N2↑
Ce4++Fe2+=Ce3++Fe3+。
(4)配制叠氮化钠溶液时,除需用到烧杯、玻璃棒、量筒外,还用到的玻璃仪器有_____________。
(5)试样中NaN3的质量分数为_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】自然界存在丰富的碳、氮、硅、磷、铁、铜等元素,它们可形成单质及许多化合物。回答下列问题:
(1)C、N、Si原子的第一电离能由大到小的顺序是____________________。
(2)亚磷酸(H3PO3)与过量NaOH反应生成亚磷酸氢二钠(Na2HPO3),则亚磷酸的结构式为________________________。
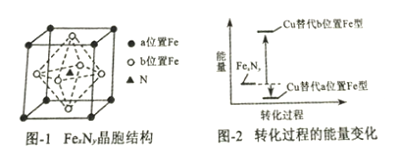
(3)某FexNy的晶胞结构如图-1所示,Cu可以完全替代该晶体中a位置Fe或者b位置Fe,形成Cu替代型产物Fe(x-n)CunNy。FexNy转化为两种Cu替代型产物的能量变化如图-2所示,其中更稳定的Cu替代型产物的化学式为___________________。
(4)乙酰基二茂铁是常用汽油抗震剂,其结构如图3所示,该物质中碳原子的杂化方式有___________,亚铁离子具有强还原性,从电子排布的角度解释其原因_______________。

(5)金刚石晶胞结构如图-4,立方BN结构与金刚石相似、硬度与金刚石相当。在立方BN晶体中,B原子与N原子之间共价键与配位键数目比为____________;每个N原子周围最近且等距离的N原子数为_______________;如果阿伏加德罗常数近似取6×1023mol-1,立方BN的密度为ag·cm-3,摩尔质量为bg·mol-1,计算晶体中最近的两个N原子间距离是_________nm(用含a、b代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com