
科目: 来源: 题型:
【题目】白花丹酸具有镇咳祛痰的作用,其合成路线流程图如下:

(1)写出B中含氧官能团的名称______________。
(2)写出A→B的化学方程式________________ 。
(3)C的分子式为__________。C→D、E→F的反应类型分别为___________和_________。
(4)白花丹酸分子中混有 ,写出同时满足下列条件的该有机物的一种同分异构体的结构简式_____________。
,写出同时满足下列条件的该有机物的一种同分异构体的结构简式_____________。
①分子中有四种不同化学环境的氢原子;②与FeCl3溶液能发生显色反应,且1mol该物质最多能与3molNaOH反应。
(5)某物G是A的同分异构体,满足下列条件的G的同分异构体有________种。
①与三氯化铁溶液发生显色反应。 ②苯环上有两个取代基
(6)已知:![]() ,根据已有知识并结合相关信息写出以
,根据已有知识并结合相关信息写出以![]() 为原料制备
为原料制备 的合成路线流程图(合成路线流程图示例参考本题题干)_____________。
的合成路线流程图(合成路线流程图示例参考本题题干)_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】元素及其化合物在化工、医药、材料等领域有着广泛的应用,回答下列问题:
(1)参照下图B、F元素的位置,依据第二周期元素第一电离能的变化规律,用小黑点标出C、N、O三种元素的相对位置。_________
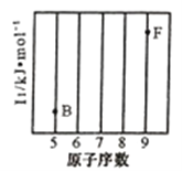
(2)碳的一种单质的结构如图(a)所示,则碳原子的杂化轨道类型为__________________。
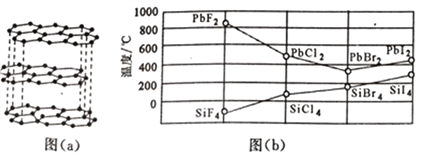
(3)二卤化铅PbX2的熔点如图(b)所示,可推断:依F、Cl、Br、I次序,PbX2中的化学键的离子性__________(填“增强”、“ 不变”或“减弱”,下同),共价性__________。
(4)NH3和F2在Cu催化下可发生反应4NH3+3F2![]() NF3+3NH4F,化学方程式中的5种物质所属的晶体类型有_____(填序号)。写出基态铜原子的价电子排布式_____________。
NF3+3NH4F,化学方程式中的5种物质所属的晶体类型有_____(填序号)。写出基态铜原子的价电子排布式_____________。
a.离子晶体 b.分子晶体 c.原子晶体 d.金属晶体
(5)BF3与一定量水形成(H2O)2·BF3晶体Q,Q在一定条件下可转化为R:
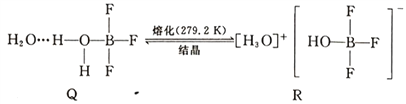
晶体R中含有的化学键包括____________。
(6)水杨酸第一级电离形成离子![]() ,相同温度下,水杨酸的Ka2_________苯酚(
,相同温度下,水杨酸的Ka2_________苯酚(![]() )的Ka(填“>”“ =”或“<”),其原因是_______________。
)的Ka(填“>”“ =”或“<”),其原因是_______________。
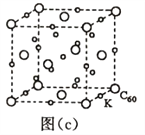
(7)碳的另一种单质C60可以与钾形成低温超导化合物,晶体结构如图(c)所示,K位于立方体的棱上和立方体的内部,此化合物的化学式为_____________;其晶胞参数为1.4nm,阿伏加德罗常数用NA表示,则晶体的密度为_________g·cm-3。(只需列出式子)
查看答案和解析>>
科目: 来源: 题型:
【题目】已知A是一种常见金属,F是一种红褐色沉淀。试根据图中转化关系,回答下列问题。
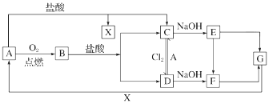
(1)写出A、C、F、G的化学式:A________;C________;F________;G________。
(2)保存C溶液时要加固体A的原因是______________________。
(3)写出下列转化的离子方程式。
①D→C:___________________________________________________;
②C→D:___________________________________________________;
③B→C+D__________________________________________________。
(4)写出E→F的化学方程式:__________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】对于常温下pH=1的硝酸溶液,有关叙述:
①该溶液1mL稀释至100mL后,pH=3
②向该溶液中加入等体积、pH=13的氢氧化钡溶液恰好完全中和
③该溶液中硝酸电离出的c(H+)与水电离出的c(H+)之比值为1×10﹣12
④向该溶液中加入等体积、等浓度的氨水,所得溶液pH=7
其中正确的是
A. ①② B. ①③ C. ②④ D. ③④
查看答案和解析>>
科目: 来源: 题型:
【题目】某校课外活动小组为了探究铜与稀硝酸反应产生的是NO气体,设计了如下实验。实验装置如图所示(已知NO、NO2能与NaOH溶液反应):
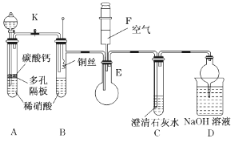
(1)设计装置A的目的是________________________________________,为达此目的应进行的操作____________________________________________________________________________;A中反应的化学方程式是_________________________________________________________。
(2)在(1)中的操作后将装置B中铜丝插入稀硝酸,并微热之,观察到装置B中的现象是_______;B中反应的离子方程式是_________________________________________________________。
(3)装置E和F的作用是__________________________________________________________,为实现此目的,操作方法是_______________________________________________________。
(4)D装置的作用是_______________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(一)有以下几种物质:①碳酸氢钠晶体 ②液态氯化氢 ③铁 ④蔗糖 ⑤酒精 ⑥熔融的K2SO4 ⑦干冰 ⑧石墨。试回答(填序号):
(1)以上物质能导电的是_________________________。
(2)以上物质中属于非电解质的是_________________________。
(3)以上物质中溶于水后水溶液能导电的是_________________________。
(4)①、②在水溶液中反应的离子方程式为_________________________________。
(二)某溶液的溶质可能由下列离子组成:Cl-、![]() 、
、![]() 、H+、Ba2+、Na+,某同学进行了如下实验:
、H+、Ba2+、Na+,某同学进行了如下实验:
Ⅰ 向溶液中加入过量的BaCl2溶液,有白色沉淀产生,过滤;
Ⅱ 向Ⅰ中滤液中加入AgNO3溶液,有白色沉淀产生;
Ⅲ 将Ⅰ中的沉淀加入稀盐酸中,沉淀部分消失,有气体产生。
(5)依据以上实验可以推断,原溶液中一定含有____________ (用离子符号表示,下同);一定没有______________;可能含有________________,检验是否存在该离子的方法为_____________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学研究小组探究外界条件对化学反应mA(g)+nB(g)![]() pC(g)的速率和平衡的影响图像如下,下列判断正确的是
pC(g)的速率和平衡的影响图像如下,下列判断正确的是

A. 由图1可知,T1<T2,该反应正反应为吸热反应
B. 由图2可知,该反应m+n<p
C. 图3中,点3的反应速率V正>V逆
D. 图4中,若m+n=p,则a曲线一定使用了催化剂
查看答案和解析>>
科目: 来源: 题型:
【题目】某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂。请填写下列空白:
(1)下图中______(填“A”或“B”)是碱式滴定管,进行该实验的第一步操作是____________________。
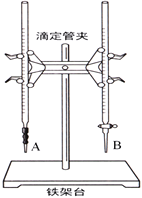
(2)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视锥形瓶中溶液颜色变化,直到因加入一滴盐酸后,出现_____________________________(填“现象”)说明达到滴定终点。
(3)下列操作中可能使所测NaOH溶液的浓度数值偏低的是(____)
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
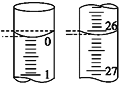
(4)若滴定开始和结束时,酸式滴定管中的液面如图所示,则所用盐酸溶液的体积为________mL。
(5)某学生根据3次实验分别记录有关数据如下表:
滴定次数 待测NaOH溶液的体积/mL | 0.100 0 mol·L-1盐酸的体积/mL | ||
滴定前刻度 | 滴定后刻度 | ||
第一次 | 25.00 | 0.00 | 26.11 |
第二次 | 25.00 | 1.56 | 30.30 |
第三次 | 25.00 | 0.22 | 26.31 |
依据上表数据列式计算该NaOH溶液的物质的量浓度(写出简要过程)。______________
查看答案和解析>>
科目: 来源: 题型:
【题目】CoCO3可用作选矿剂、催化剂及伪装涂料的颜料。以含钴废渣(主要成CoO、Co2O3,还含有Al2O3、ZnO等杂质)为原料制备CoCO3的一种工艺流程如下:
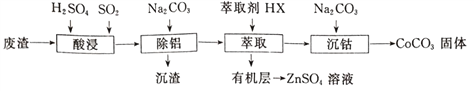
下表是相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol·L-1计算):
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
Co2+ | 7.6 | 9.4 |
Al3+ | 3.0 | 5.0 |
Zn2+ | 5.4 | 8.0 |
(1)写出“酸溶”时发生氧化还原反应的化学方程式_________________。
(2)“除铝”过程中需要调节溶液pH的范围为______________,形成沉渣时发生反应的离子方程式为_____________________。
(3)在实验室里,萃取操作用到的玻璃仪器主要有____________;上述“萃取”过程可表示为ZnSO4(水层)+2HX(有机层) ![]() ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是_________________________。
ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是_________________________。
(4)“沉钴”时,Na2CO3溶液滴加过快会导致产品不纯,请解释原因_________________。
(5)在空气中煅烧CoCO3生成钴氧化物和CO2,测得充分煅烧后固体质量为2.41g,CO2的体积为0.672L(标准状况),则该钴氧化物的化学式为____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com